GENERALIDADES
La resistencia que ejercen las bacterias a los antibióticos,
antisépticos y desinfectantes, es un problema de salud
pública que se creía superado. Desde el descubrimiento de
los primeros antibióticos, los microorganismos han sido
capaces de evadir su acción. Un ejemplo que ofrece
muestras evolutivas de resistencia, es la bacteria Staphylococcus
aureus, que en 1946 presentaba la mayoría de sus
cepas sensibles a la penicilina; en la actualidad casi todas
las cepas hospitalarias, son resistentes a bencilpenicilina y
algunas lo son a meticilina, gentaminicina o a ambas y sólo
se pueden tratar con vancomicina .
Además, en los
últimos 25 años la comunidad ha adquirido microorganismos
resistentes a múltiples fármacos, por ejemplo Mycobacterium
tuberculosis, Salmonella spp, Shiguella spp,
Vibrio cholerae, Streptococcus pneumoniae, que, al
aumentar, causan infecciones en ambientes nosocomiales;
y dejan en claro que la resistencia a los fármacos constituye
un problema de salud pública extremadamente grave4-6.
Durante los últimos veinte años el uso indiscriminado
de estos productos ha hecho que las bacterias dotadas de
múltiples mecanismos (bioquímicos, genéticos-moleculares
y celulares) desarrollen estrategias inherentes y adquiridas,
que les permiten evadir con efectividad la acción de
estos compuestos. Se calcula que más de 50% de las
prescripciones médicas de antibióticos en los hospitales,
se ordenan sin pruebas claras de infección o sin una
indicación médica adecuada7
. Otros factores que contribuyen
al desarrollo de la resistencia son:
1. Las medidas ineficientes para el control de infecciones
en los centros hospitalarios:
2. La falta de campañas educativas en el uso y manejo de
los medicamentos, debido a las condiciones de pobreza
e ignorancia en las prescripciones.
3. La severidad de las enfermedades y el manejo de
pacientes en las unidades de cuidados intensivos.
4. La colonización previa por microorganismos con resistencias
múltiples.
5. Los procedimientos invasivos como cateterización y
diálisis.
6. El uso de antibióticos en agricultura y acuacultura
ocasiona la presencia de residuos de antibióticos en la
carne de los animales y la selección de bacterias
resistentes en los intestinos de los animales de consumo
humano, llevan a una exposición directa de los consumidores
a estos fármacos. Además, se pueden encontrar
gérmenes resistentes en los alimentos de origen
vegetal cuando se irrigan con aguas residuales o
cuando se aplican antibióticos a los cultivos.
7. Factores del medio: La presencia de bacterias resistentes
en nacimientos de agua se ha documentado en
varias partes del mundo. La resistencia se puede deber
a la producción natural de antibióticos por bacterias del
suelo, que actúan como reservorios naturales de genes
de resistencia y suministran el principio de genes
transferibles.
8. El uso de elementos para limpieza casera, ha incrementado
de modo notorio en los últimos años. Las
sustancias antibacterianas añadidas a estos elementos
son semejantes a los antibióticos en su acción y pueden
apresurar la resistencia en ciertas cepas.
La infección bacteriana es un proceso complejo donde
interactúan tanto la bacteria como el estado inmunológico,
fisiológico y genético del hospedero. En este contexto los
gérmenes oportunistas se convierten en los principales actores de las infecciones nosocomiales en individuos con
inmunodeficiencias, con daños en las barreras de sus
epitelios o con enfermedades previas.
En la interacción
hospedero-parásito hay un nuevo elemento fruto de la
«evolución cultural» humana, los antimicrobianos, que han
sido efectivos en el tratamiento de la infección. Sin
embargo, las bacterias se han hecho resistentes a los
mismos. Una vez que se introduce un antibiótico en el
mercado, la aparición de cepas con resistencia es cuestión
de tiempo, y demuestra que el medicamento que más se
prescribe en un momento dado, es al que las bacterias
desarrollan la resistencia. Las cepas resistentes a antibióticos
aparecieron al principio en hospitales donde éstos
se usaban frecuentemente. Str. pyogenes resistente a
las sulfonamidas emergió en hospitales militares en la
década de 1930. Staph. aureus resistente a las penicilinas
apareció poco después de iniciarse el uso de este
antibiótico en hospitales civiles de Londres en la década de
1940. De manera similar M. tuberculosis resistente a
estreptomicina surgió en la comunidad poco después del
descubrimiento de este antibiótico.
La resistencia a múltiples fármacos se descubrió en
enterobacterias como Escherichia coli, Shigella y
Salmonella a finales de la década de 1950 y comienzos de
la década de 196015,16. Debido al uso indiscriminado de
antimicrobianos, la resistencia se diseminó en diferentes
bacterias y se hizo más común, no sólo en países en vía de
desarrollo, donde los antibióticos se consiguen sin prescripción
médica, sino en países del primer mundo, donde
su suministro se lleva a cabo bajo controles más estrictos.
Con el fin de hacer claridad, se unificarán varias palabras
importantes para esta revisión. «Biocida» es un
término general para describir una sustancia química,
usualmente de amplio espectro, que inactiva los microorganismos.
Como los biocidas se relacionan con actividad
antimicrobiana, otros vocablos pueden ser más específicos,
por ejemplo «-estático», que se refiere a agentes que
inhiben el crecimiento (e.g., bacteriostático, fungiestático
y esporostático) y «-cida», que hace referencia a agentes
que matan al organismo blanco (e.g., esporicida, virucida
y bactericida). «Antibiótico» se define como una sustancia
orgánica, natural o sintética, que inhibe o destruye en
forma selectiva bacterias y otros organismos, generalmente
a bajas concentraciones; los antisépticos son biocidas
o sustancias que destruyen o inhiben el crecimiento de
microorganismos y que son seguros para su aplicación en
tejido vivo y los desinfectantes son similares, pero por lo
general son sustancias o biocidas que se usan sobre
objetos inanimados o en superficies. Los desinfectantes
pueden ser esporostáticos, pero no son esporocidas.
Desde siglos atrás se emplean compuestos como la sal
para conservar los alimentos, las vasijas de plata y cobre
en el almacenamiento de agua potable, la miel y el vinagre
para la limpieza de heridas. Luego se utilizaron compuestos
yodados como desinfectantes de heridas, agua clorada
en pacientes obstétricas, alcohol como desinfectante de
manos y fenol tanto en la limpieza de heridas como en
cirugías antisépticas.
Los antisépticos y desinfectantes se usan ampliamente
en hospitales, centros de salud y laboratorios en los procesos
de control y desinfección y sobre todo en la prevención
de infecciones nosocomiales.
La resistencia bacteriana a los biocidas fue descrita en
las décadas de 1950 y 1960 y ha ido en aumento. Ciertos
biocidas como alcoholes, formaldehídos, biguanidas,
yodoforos, aldehídos y agentes catiónicos como los compuestos
de amonio cuaternario (CUAs), la clorhexidina
y el triclosán se han comprometido como posibles causantes
de la selección y persistencia de cepas bacterianas con
bajo nivel de resistencia a los antibióticos.
El uso generalizado de antisépticos y desinfectantes
genera expectativas sobre la resistencia bacteriana provocada
por la presión ambiental que ejercen los productos
ya mencionados, y enfoca el interés hacia la posible
resistencia cruzada con antibióticos.
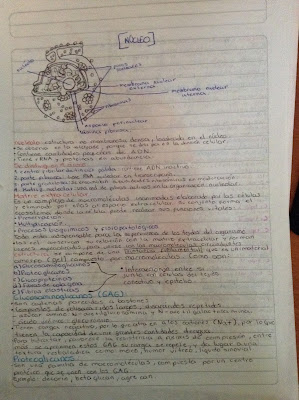
MECANISMOS DE RESISTENCIA A LOS
ANTISÉPTICOS Y DESINFECTANTES
En la actualidad se ha obtenido un avance considerable
en la comprensión de la respuesta de las bacterias a los
bactericidas. La resistencia puede ser una propiedad
natural de un organismo (intrínseca) o conseguida por
mutación o adquisición de plásmidos (autorreplicación,
ADN extracromosómico) o transposones (cromosomal o
integrado en plásmidos, cassettes de ADN transmisibles).
Los genes de resistencia naturales en plásmidos, se originan
como mutaciones puntuales en los genes blanco (sitios
de inserción de los genes de resistencia) de bacterias
susceptibles y también de genes que les proveen protección
contra otras bacterias. La resistencia intrínseca se
ha demostrado para bacterias gramnegativas, esporas
bacterianas, micobacterias y bajo ciertas condiciones en especies del género Staphylococcus. En el Cuadro 1 se
resumen los mecanismos de acción y los blancos de los
principales agentes químicos utilizados en desinfección.
Resistencia intrínseca a bacterias gramnegativas.
Las bacterias gramnegativas por lo general son más resistentes
a los antisépticos y desinfectantes que las grampositivas.
Se han hecho estudios donde se midieron las
concentraciones mínimas inhibitorias (CIM) que presentan
tanto las grampositivas como las gramnegativas, y se
estableció que hay diferencias marcadas entre Staph.
aureus y E. coli a los compuestos de amonio cuaternario
(CAC), hexaclorofeno, diamidinas y triclosán, pero poca
diferencia en la susceptibilidad a la clorhexidina. Pseudomonas
aeruginosa es más resistente a la mayoría de estos agentes, incluyendo la clorhexidina.
La membrana externa de las bacterias gramnegativas
actúa como una barrera que limita la entrada de varios
tipos de agentes antibacterianos sin relación química. Las
moléculas hidrofílicas de bajo peso molecular pasan fácilmente
a través de las porinas, en cambio las moléculas
hidrofóbicas se difunden a través de la bicapa de la
membrana. Además de las vías antes descritas se ha
propuesto una tercera vía para agentes catiónicos como
los CAC, biguanidas y diamidinas, los cuales dañan la
membrana y facilitan su autocaptación. Un ejemplo
claro de resistencia mediada por la membrana externa es
el de P. aeruginosa que presenta diferencias en la
composición del lipopolisacárido (LPS) y el contenido de
cationes como el magnesio, que produce enlaces estables
entre moléculas de LPS y como complemento a este
mecanismo, esta bacteria presenta porinas pequeñas que
impiden el paso por difusión de ciertas sustancias. Algunas
cepas que son muy resistentes a clorhexidina, CAC,
EDTA y diamidinas se han aislado de muestras clínicas.
La presencia de un LPS menos ácido en la membrana
externa puede ser un factor que contribuye a la resistencia
intrínseca
martes, 9 de febrero de 2016
- University of Sheffield is part of a landmark collaboration with the MRC and the Government of India to fund three major global research centres
- Una K-India Centre aims to minimise the indiscriminate use of antibiotics
- Researchers from the University of Sheffield are set to tackle some of the largest global health problems thanks to a landmark collaboration between the UK Medical Research Council (MRC) and the Government of India Department of Biotechnology (DBT)
Nearly £7 million will be invested by the UK, through the MRC and the Newton Fund, and India through the DBT, to develop three major global research centres using high quality research teams – including scientists from the University of Sheffield.
 One of the ground-breaking centres, the UK-Indian Centre for Advanced Technology for Minimising the Indiscriminate use of Antibiotics (UKICAT-MA), will focus on research into antimicrobial resistance (AMR) and will be led by the University of Sheffield and University of Bradford to establish smart materials for the detection and target delivery of antibiotics for eye infections. Professor Stephen Rimmer from the University of Sheffield’s Department of Chemistry, who is part of the expert team, said: “Resistance to antibiotics is becoming one of the most important challenges of our age.
One of the ground-breaking centres, the UK-Indian Centre for Advanced Technology for Minimising the Indiscriminate use of Antibiotics (UKICAT-MA), will focus on research into antimicrobial resistance (AMR) and will be led by the University of Sheffield and University of Bradford to establish smart materials for the detection and target delivery of antibiotics for eye infections. Professor Stephen Rimmer from the University of Sheffield’s Department of Chemistry, who is part of the expert team, said: “Resistance to antibiotics is becoming one of the most important challenges of our age.
“A number of challenges exist if we are to avoid descent into a post-antibiotic age, including the development of: new antibiotics; new diagnostics and improved delivery systems.
“UKICAT-MA will establish materials for both detection, at the point-of-care, of ocular infections and the targeted delivery of antibiotics to infected sites in the eye.
“The enormous benefit of detecting something which works in both a UK and Indian environment is that it will help everyone across the world.”
The Centre involves a multidisciplinary team from the University of Sheffield and University of Bradford (Polymer Chemistry, Clinical and Mechanistic Microbiology and LV Prasad Ophthalmology).
Much of the work is based around the idea that certain materials respond to bacteria by changing state on binding to bacteria.
These conformational changes are then either monitored to provide a signal of the presence of the bacteria or they provide a basis for targeting antibiotics to bacteria whilst reducing effects on surrounding tissues.
UKICAT-MA will develop these smart materials to produce contact lenses that give colour indications of bacterial infections and systems for local delivery of therapeutics to infected ocular tissues.
Dr Mark Palmer MRC Director of International Strategy, said: “With a 100-year history of strategic international collaboration, MRC scientists today collaborate with researchers in more than 100 countries. We know diseases don’t recognise international borders and that addressing health problems around the world demands a global response.
“These exciting partnerships between excellent scientists in India and the UK is a key part of our international effort to pool expertise and resources and deliver research that will make a real difference to global health.”
Prof K VijayRaghavan, Secretary of the Department of Biotechnology, said: “The Department of Biotechnology,
Government of India, is delighted to partner with the MRC in creating research centres which will address vexing challenges in medicine through quality science and collaboration. India is committed to working with the best in the world, for India and for the world. “We are acutely aware that the fruits of our partnership can mean better lives for the most needy everywhere and are committed to make the collaboration succeed.”
Government of India, is delighted to partner with the MRC in creating research centres which will address vexing challenges in medicine through quality science and collaboration. India is committed to working with the best in the world, for India and for the world. “We are acutely aware that the fruits of our partnership can mean better lives for the most needy everywhere and are committed to make the collaboration succeed.”
Consequences of Excessive Antibiotic Use
by Jane Sheppard 3 Comments
By Jane Sheppard
Antibiotics have saved many lives over the past 45 years. We are truly fortunate to have them available for serious bacterial infections. Unfortunately, antibiotics are excessively prescribed, especially to children. The Center for Disease Control estimates that of the 235 million doses of antibiotics given each year, between 20 and 50 percent are unnecessary. Tragically, this overuse of antibiotics can cause devastating health consequences to children.
Antibiotics for Ear Infections
Antibiotic misuse is most likely to occur in children with ear infections (otitis media), the number one reason a child is brought to a doctor. Antibiotic therapy is the most common treatment of ear infections, with amoxicillin being the first choice by doctors. The side effects of amoxicillin include upset stomach, diarrhea, allergic reactions, and diaper rashes. These side effects may seem minor, but are these antibiotics actually necessary for otitis media?
The purpose of antibiotics is to kill harmful bacteria. Otitis media means middle ear inflammation – not necessarily bacterial infection. Many cases are caused by allergies, particularly to milk and dairy products. In a significant number of cases of otitis media, the middle ear contains no harmful bacteria. In a Dutch study of 2,975 children, it was found that 88% of children with acute otitis media did not need antibiotics. Other studies in the U.S. and Scandinavia came to similar conclusions.
Antibiotics have been shown to increase the likelihood of repeat ear infections. One reason is when a doctor prescribes antibiotics the underlying cause of the ear infection is usually ignored and left untreated. For instance, Streptococcus pneumoniae, also known as pneumococcus is commonly found in the nose and throat. This bacterium is thought to be responsible for many cases of ear infections, which is why antibiotics are prescribed. However, your child can have pneumococcus and not be sick. It will only cause trouble if it gets trapped in the middle ear. Once trapped, the bacteria can reproduce rapidly and become an infection. This scenario could be the result of an allergic reaction to a certain food, which can cause congestion as well as significant pressure changes and obstruction to the eustachian tube. In the case of an allergy induced ear infection, eliminating the allergen from a child’s diet or environment will also eliminate the obstruction, allowing the bacterial fluid to drain. However, if an allergic child
to be exposed to the allergen, repeat ear infections are likely to occur.
Another cause of ear infection may be an obstruction to the eustachian tube, due to misalignment of the bones of the jaw, skull or neck. Craniosacral work, chiropractic care or osteopathy would be especially helpful to release the blockage to allow drainage of the fluid.
Nutritional deficiencies or a weakened immune system can also be factors leading to ear infections. Treating the child with antibiotics without correcting the cause will likely create a continuing cycle of repeat ear infections. Many children are dealing with this. A typical scenario is the child is diagnosed with acute otitis media and antibiotics are prescribed (whether a bacterial infection is present or not). The symptoms disappear in about a week or two, but return again in the near future, since the original cause was not addressed. The child goes back to the doctor for more antibiotics. The cycle . Some children spend months or even years on antibiotics, with recurring ear infections. Research has shown that when antibiotics are used at the beginning of an ear infection, the frequency of recurrence may be almost three times greater than if antibiotics are delayed or not used.
Antibiotics Don’t Discriminate
Antibiotics do not just go after the pathogenic or “bad” bacteria. They also indiscriminately destroy the beneficial bacteria necessary and vital to good health. Among the more important beneficial bacteria are lactobacillus acidophilus and bifidobacterium bifidus. They help protect the body against infection. Depleting these organisms can disrupt the balance of the body, suppress immunity, and lead to increased susceptibility to infections by fungi, bacteria, viruses and parasites. Additionally, when antibiotics are used excessively, depleting the beneficial bacteria, there may be an overgrowth of yeast in the body. A yeast infection can suppress immunity, which may lead to recurrent infections.
What’s more, antibiotics adversely affect many nutrients, particularly the ones needed by the immune system to fight infection, such as vitamins A and C. One of the most common side effects of antibiotics is diarrhea. This causes a loss of nutrients, especially magnesium and zinc. Some children are on antibiotics for months or even years. Nutritional loss over such a long period of time is debilitating for the body and sets up an environment for more infections.
Serious Infectious Diseases Resistant to Antibiotics
A very frightening consequence of indiscriminate use of antibiotics is the development of antibiotic-resistant bacteria. These bacteria have “learned” to outsmart the drugs and have reproduced a generation of stronger, more resistant bugs. Consequently, there are some serious infectious diseases that are no longer responding to antibiotics. If an infection does respond, it often requires five to ten times the amount of the drug that used to be effective.
When your child is continually treated with antibiotics, the bacteria in his or her body may eventually be able to survive the drugs, making it much harder to cure an infection. In the event of a serious bacterial infection, such as meningitis, a much higher dosage of antibiotic may be required or a doctor may have to try different drugs before finding one that will work. The time this takes can potentially be a matter of life or death, since meningitis can be fatal and needs to be treated immediately. Unfortunately, with each try at a different treatment, the bacteria are given another chance to build up their resistance against even more powerful drugs.
Antibiotic resistance can affect the whole family and everyone around the child with a history of frequent antibiotic use. If the child develops resistant bacteria, he or she can pass them along to others through coughing, sneezing, and kissing.
What Else is Your Child Ingesting with the Antibiotic?
Sweeteners, dyes, flavorings, and other unnamed additives are found in antibiotics prescribed to children. These may include saccharin, sucrose, red dye #40, FD & C yellow #5 and #6. These dyes are cross-reactive with aspirin and acetaminophen, which are commonly given to a child during an illness. Even tiny amounts of the chemical additives in antibiotics can cause an allergic reaction in a sensitive child. It’s important to always get a full disclosure of the contents of the drug being considered if your child has allergies or environmental sensitivity. Ask the pharmacist for the insert that comes with the medication.
Treat Colds and Flu with Antibiotics?
A truly disturbing practice is the prescribing of antibiotics by some doctors to treat colds, coughs, runny noses or flu. Most upper respiratory infections are viral. Treating them with antibiotics is clear and blatant misuse, since the drugs kill only bacteria and are of no value at all in treating viral infections. There are treatments that can relieve the symptoms of a cold, but there is no drug (over-the-counter or prescription) that will cure a cold.
Save Antibiotics for the Serious Infections
In the book Beyond Antibiotics: 50 Ways to Boost Immunity and Avoid Antibiotics, Drs. Schmidt, Smith and Sehnert suggest that you ask your doctor the following questions when antibiotics are being prescribed. It is good to get all the answers you can before making a decision.
Are you sure it is bacterial?
Are you sure it is the right antibiotic?
Should a culture be performed?
Are there alternatives to antibiotics?
What are the risks if we don’t use them?
What are the risks if we wait one or two or four days?
Are there dietary or nutritional factors that need consideration?
Should vitamins be prescribed along with the antibiotic?
Should probiotic supplements be given to minimize the intestinal effect of the antibiotic?
Have you considered or investigated the role of food allergy?
If your doctor is not willing to explore these questions, you are justified in getting another opinion. There are many doctors who will be your health partner and explore these issues with you.
Antibiotics may be absolutely necessary in certain situations, such as a life-threatening infection or when serious complications are present. For instance, if your child has symptoms of bacterial meningitis, there is no time to waste. He or she should be taken immediately to a doctor for antibiotics. We are very fortunate to have antibiotics for appropriate situations. However, antibiotics should be used in conjunction with methods that strengthen the immune system, and the depleted beneficial bacteria should always be replaced. Most importantly, the cause of the infection needs to be addressed for true healing to take place.
Rol de pre y probióticos en la prevención y tratamiento de infecciones infantiles
En la última década, las fórmulas para lactantes y los productos alimentarios que se comercializan para niños se han ido complementando cada vez más con probióticos, prebióticos o con la combinación de ambos: los simbióticos.

Autor: Dres. Stefan Weichert, Horst Schroten, and Rudiger Adam Pediatr Infect Dis J 2012; 31: 859-862
La distribución y uso de estos productos parece superar la comprensión básica de cómo funcionan los probióticos y cual es el impacto a largo plazo que tienen sobre la modulación de la flora intestinal. Además, la interpretación y extrapolación de los datos es limitada, debido principalmente a la gran heterogeneidad de los estudios clínicos con respecto a los diferentes géneros, cepas, dosis, ambientes de estudio y medidas de resultado.
No obstante, con el aumento del número de estudios bien conducidos, está creciendo la evidencia a favor o en contra del uso de pro y prebióticos. Este artículo se centra en la evidencia de los beneficios clínicos de los prebióticos, probióticos y simbióticos para la prevención y tratamiento de enfermedades infecciosas en pediatría.
Definiciones y justificación para su uso
Los probióticos son microorganismos vivos que cuando se administran en dosis adecuadas, confieren un beneficio para la salud del huésped. Por el contrario, los prebióticos son alimentos no digeribles que afectan beneficiosamente al huésped mediante la estimulación selectiva del crecimiento y/o actividad de un número limitado de bacterias en el colon. Los simbióticos son la combinación de los probióticos y prebióticos.
La justificación del uso de los probióticos se basa principalmente en su capacidad de remodelación de las colonias microbianas, y por lo tanto de promover el crecimiento y la sobrevida de bacterias comensales en favor del sobrecrecimiento de bacterias patógenas. Además, ejercen funciones inmunomoduladoras, influyen y promueven in vitro la diferenciación de células epiteliales, la proliferación y la función de la barrera intestinal.
Los prebióticos comercializados se desarrollaron con éxito para imitar los efectos de los oligosacáridos encontrados en la leche materna. Se utilizan selectivamente para promover la colonización, el crecimiento, la sobrevida y la función de las bacterias comensales, y posiblemente modular el sistema inmune. Debido a sus diferencias estructurales con los oligosacáridos de la leche materna, pueden carecer de la capacidad para promover beneficios de salud adicionales más allá de su función prebiótica.
Prevención de las enfermedades infecciosas en general
En un estudio observacional reciente (771 lactantes), se observó que el grupo que recibió una fórmula de continuación suplementada con simbióticos tuvo significativamente menos enfermedades infecciosas (EI) en general en comparación con el grupo control (31,0% vs. 40,6%, P <0,05), mientras que en el análisis para EIs específicas sólo la frecuencia de las infecciones gastrointestinales mantuvo diferencias significativas (3,5% vs. 6,8%, P = 0,03). Un estudio randomizado y controlado (ERC) demostró una disminución del 30% en el número total de EIs en el grupo con probióticos en comparación con el grupo control (razón de la tasa de incidencia: 0,70; P = 0,003). No hubo efectos sobre el total de episodios febriles entre el grupo de intervención y el control en este estudio. Van Stuijven¬berg y colaboradores investigaron específicamente el impacto de los prebióticos sobre los episodios febriles durante el primer año de vida, pero no pudieron demostrar una reducción en el grupo de intervención. En un estudio reciente se demostró que durante el periodo de intervención (0-6 meses), un menor número de niños recibieron antibióticos en el grupo con simbióticos en comparación con el grupo placebo (23% vs. 28%; odds-ratio: 0,74 [Intervalo de confianza del 95% [IC 95%]: 0.55-1.00], P <0,049). En contraste, los autores no observaron diferencias en el consumo de antibióticos durante el periodo de seguimiento (6-24 meses). Queda por verse si los posibles efectos beneficiosos de los probióticos sobre las EIs en general pueden confirmarse en nuevos estudios, o si estos efectos pueden atribuirse a la reducción de EIs específicas.
Infecciones respiratorias
Un ERC (571 niños, 1-6 años de edad) no mostró diferencias en la ocurrencia de otitis media (OM) entre el grupo de intervención que utilizó Lactobacillus rhamnosus GG (LGG) y el grupo control (72% vs. 65%, OR = 1,48 [IC 95%: 0.87- 2,52]) durante los 7 meses del periodo de estudio, pero mostró diferencias hacia una menor incidencia de infecciones del tracto respiratorio superior (ITRS) recurrentes (≥ 4) (OR = 0,56 [IC 95%: 0,31-0,99]). Se hallaron resultados opuestos para la incidencia de OM en un estudio de 72 lactantes (<2 meses de edad, en seguimiento hasta los 12 meses), que recibieron LGG y Bifidobacterium lactis o placebo. Durante los primeros 7 meses de vida, los niños del grupo de intervención experimentaron significativamente menos episodios de OM en comparación con el grupo control (22% vs. 50%, riesgo relativo [RR]: 0,44 [IC 95%: 0,21-0,90], P = 0,014). El grupo con probióticos también tuvo menos infecciones respiratorias recurrentes en el primer año de vida (28% vs. 55%; RR: 0,51 [IC 95%: 0,27-0,95], P = 0,022).
En un ERC basado en población, los investigadores pudieron demostrar una reducción del 24% en la incidencia de neumonía (IC 95%: 0-42%; P = 0,05), y del 35% en la incidencia de infección aguda severa del tracto respiratorio inferior (IC 95%: 0-58%; P = 0,05) en el grupo de intervención con simbióticos en comparación con el grupo control.
Maldonado y colaboradores demostraron una reducción del 27% en la tasa de incidencia de ITRS en niños del grupo de intervención en comparación con el grupo control durante el período de estudio (razón de la tasa de incidencia: 0,729, P = 0,026), pero no encontraron diferencias en la tasa de incidencia de OM o de infección del tracto respiratorio inferior. Los datos analizados a partir de 10 ERC (incluyendo 8 estudios que involucraron niños) a partir de una revisión sistemática reciente de Cochrane demostraron que los probióticos fueron mejores que el placebo con respecto a la incidencia de ITRS. No obstante, la heterogenicidad de los datos y la variada calidad de los estudios limitaron las recomendaciones basadas en la evidencia para el uso generalizado de los probióticos para prevenir infecciones respiratorias.
Los datos sobre prebióticos en este aspecto son escasos. Los lactantes que recibieron leche de fórmula suplementada con una mezcla de galactooligosacáridos y fructooligosacáridos durante los primeros 6 meses de vida tuvieron un menor riesgo de ITRS (14/102 vs. 30/104; RR: 0,5 [IC del 95%: 0.3-0.8]), y una tasa reducida de infecciones recurrentes del tracto respiratorio (3% vs. 10%; RR: 0,3 [IC 95%: 0,09-0,99]), pero presentaron incidencias similares de OM en comparación con los niños del grupo control alimentados con fórmula no suplementada.
Prevención de diarrea aguda
Una revisión sistemática reciente de ERCs para probióticos en niños sólo mostró un modesto beneficio para la prevención de la diarrea aguda en niños sanos. Los resultados de tres estudios agrupados, en los que la cepa más frecuentemente utilizada fue B. lactis, mostraron una reducción significativa del riesgo de infecciones gastrointestinales (3 ECA; n = 302; RR: 0,54 [IC 95%: 0,36-0,81]).
Por lo tanto, el Comité de Nutrición de la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica refirió que existe alguna evidencia a partir de los estudios agrupados para apoyar el suplemento de las fórmulas infantiles con B. lactis (solo o en combinación) para reducir el riesgo de infecciones gastrointestinales no específicas en los niños.
Un meta-análisis reciente de 3 ERCs (más de 1000 niños) que investigó la prevención de la diarrea asociada al sistema de salud mediante la adición de leche fermentada suplementada con LGG (o LGG en cápsulas o sobres), mostró tasas significativamente más bajas de diarrea y gastroenteritis sintomática por rotavirus en el grupo de intervención en comparación con el grupo control (RR: 0,37 [IC 95%: 0,23-0,59] y RR: 0,49 [IC 95%: 0,28-0,86], respectivamente).
Para prevenir un caso de diarrea nosocomial, 12 niños deberían ser tratados con LGG (número necesario a tratar = 12). Como este meta-análisis solo se centró en LGG, se debe ser cauteloso al extrapolar estos hallazgos para otros probióticos. En contraste, los resultados a partir de un ERC realizado recientemente utilizando otra cepa de lactobacilo (L. reuteri DSM 17938) no mostraron diferencias en la prevención de la diarrea nosocomial. En general, parece acumularse evidencia creciente de que los probióticos pueden prevenir las infecciones gastrointestinales nosocomiales en niños sanos, pero existe menos evidencia sobre la prevención de infecciones gastrointestinales en la comunidad y en guarderías. Debe destacarse que en una revisión reciente de la Academia Americana de Pediatría, los autores señalan con razón el hecho de que la vacuna contra el rotavirus es probablemente más efectiva en la prevención de la diarrea infecciosa aguda infantil que el uso de probióticos.
Tratamiento de la diarrea aguda
El papel de los probióticos en el tratamiento de la gastroenteritis aguda (viral) en lactantes y niños ha sido investigado en múltiples ensayos clínicos, lo que llevó a las recomendaciones dadas por la Sociedad Europea de Gastroenterología, Hepatología, y Nutrición Pediátrica y por la Sociedad Europea de Enfermedades Infecciosas Pediátricas que seleccionaron probióticos con eficacia clínica probada y que, administrados en dosis adecuadas según la situación y la población de pacientes, podrían ser utilizados como complemento de la terapia de rehidratación en el manejo de la gastroenteritis aguda (viral) en niños. En una revisión sistemática de Cochrane publicada recientemente, que incluyó 56 estudios con niños, los autores concluyen que los probióticos tienen claros efectos beneficiosos en el acortamiento de la duración de la diarrea infecciosa aguda con una media de 24,76 horas (IC del 95%: 15.9-33.6 horas; 35 ensayos; > 4500 participantes) y en la reducción de la frecuencia media de las deposiciones al 2°día (diferencia media 0,8; 0,45-1,14; 20 ensayos, > 2700 participantes). Los resultados de un meta-análisis actualizado de ERCs que investigó el impacto de Saccharomyces boulardii en la tratamiento de la gastroenteritis aguda (viral) en niños también demostraron una reducción en la duración de la diarrea con una mediana de 1,08 días (IC 95%: -1,64 a -0,53); 5 ERCs; 944 participantes) en el grupo de intervención con probióticos en comparación con el grupo control.
Es interesante observar que S. boulardii en combinación con metronidazol demostró también ser útil para disminuir la duración de la diarrea con sangre en niños con amebiasis en comparación con metronidazol solo (42,2 ± 17,4 horas vs. 72,0 ± 28,5 horas; P <0,001). En este contexto, también se demostró recientemente que los oligosacáridos de la leche materna, que sirven como modelo para los prebióticos sintetizados artificialmente similares a galactooligosacáridos y fructooligosacáridos, disminuyen la unión y la citotoxicidad de Entamoeba histolytica en un modelo de cultivo celular humano. Como nota, en el mismo escenario podrían ocurrir efectos similares con los galactooligosacáridos.
Diarrea asociada a antibióticos
En la mayoría de los ERCs publicados, los probióticos se administraron en paralelo con los antibióticos iniciados (más frecuentemente para el tratamiento de infecciones respiratorias agudas). Un meta-análisis de 6 ERCs mostró como resultados una reducción del riesgo de desarrollar diarrea asociada a antibióticos del 28,5% al 11,9% (RR: 0,44 [IC 95%: 0,25-0,77]; P = 0,006; número necesario a tratar = 7). Una revisión sistemática Cochrane recientemente publicada también demostró que altas dosis de prebióticos tuvieron un efecto protector, con prevención de la diarrea asociada a antibióticos en los niños tratados en comparación con el placebo (prevalencia del 8% vs. 22%, RR: 0,40 [IC 95%: 0,29-0,55]; número necesario a tratar = 7). Como muchos estudios investigaron simbióticos, los datos son escasos para los efectos de los prebióticos solamente.
Un estudio reciente sobre gastroenteritis viral en niños no pudo mostrar diferencias entre el grupo de intervención (oligofructosa e inulina) y el grupo control. A diferencia de los adultos, los efectos terapéuticos de los probióticos en la diarrea asociada a antibióticos, o en la diarrea asociada a Clostridium difficile no han sido investigados en ERCs.
Gastritis por Helicobacter pylori
Aunque existe evidencia creciente en los ERCs, especialmente en adultos, que los probióticos en combinación con la triple terapia (2 antibióticos y un inhibidor de la bomba de protones) pueden erradicar el H. pylori con mayor eficacia en comparación con la triple terapia sola (tasa de erradicación con un aumento en torno al 10%), los resultados en niños no son concluyentes.
Enterocolitis necrotizante
Los autores no focalizan esta revisión en la enterocolitis necrotizante (ECN); sin embargo, es probable que la infección desempeñe un rol en alguna etapa de la patogénesis de la ECN, aunque las interacciones exactas aún deben ser dilucidadas.
Cabe señalar que el debate actual sobre los pros y contras del rol de los probióticos en la prevención de la ECN demuestra las dificultades en la traducción de los resultados de estudios heterogéneos en recomendaciones basadas en la evidencia (y en cambios en las prácticas). En este sentido, la gravedad de los resultados de los estudios, es decir, la reducción de la mortalidad global y de la incidencia de ECN en alrededor del 50% en los lactantes que recibieron probióticos, hace que los autores tiendan a creer que no es ético negar un tratamiento que podría salvar la vida, por la realización de estudios multicéntricos, placebo/controlados. Se planteó la pregunta acerca de cuantas pruebas serían necesarias antes de cambiar las prácticas.
Sepsis
Aunque los resultados de estudios individuales podrían sugerir un efecto beneficioso o perjudicial de la administración de probióticos para prevenir la sepsis confirmada por cultivo en lactantes, los datos de los metaanálisis no confirmaron esta asociación.
Mihatsch y colaboradores investigaron si los probióticos podrían ser de utilidad en la prevención de infecciones nosocomiales en un grupo de riesgo vulnerable, los lactantes de muy bajo peso al nacer (183 niños; < 1500 gramos o menores de 30 semanas de edad gestacional). Cuando se administró B. lactis, no se pudieron demostrar diferencias en la incidencia de infecciones nosocomiales en niños de muy bajo peso al nacer, ni efectos adversos en comparación con el grupo control. Un estudio randomizado, que investigó el papel de los probióticos en la prevención de la colonización por Cándida y de la sepsis de inicio tardío, no mostró diferencias en la infección invasiva por Cándida entre el grupo de intervención y el control.
Infecciones urogenitales
Los datos de los ERCs han demostrado que no disminuyó la incidencia de las infecciones del tracto urinario (ITU) en niños que recibieron probióticos. Por otra parte, la intervención simbiótica o prebiótica no se tradujo en una menor incidencia de ITU. Es interesante notar que un estudio prospectivo demostró una incidencia similar de ITU con probióticos y con profilaxis convencional con antibióticos en niños con reflujo vesicoureteral primario persistente (18,3% [11/60] vs. 21,6% [13/60], P = 0,962). Además, la cicatrización renal no fue significativamente diferente entre los dos grupos. Si cualquier medicación "biótica" es necesaria para la prevención de las infecciones urinarias es tema para otro debate.
Infección por VIH
La transmisión vertical del VIH se incrementa 3 veces en mujeres VIH-positivas con vaginosis bacteriana. Se piensa que los probióticos influirían favorablemente la flora vaginal alterada, y los diferentes regímenes terapéuticos prometen rendir resultados. Por lo tanto, los probióticos podrían tener un impacto indirecto sobre los niños infectados por VIH. Es interesante notar que se ha demostrado que los prebióticos naturales, los oligosacáridos de la leche humana, interactúan competitivamente con el VIH por los sitios de unión al receptor in vitro.
Seguridad
En la actualidad, no existen problemas de seguridad para el uso de prebióticos y probióticos en niños sanos. Se requiere evaluación de riesgos críticos en los niños inmunosuprimidos y en aquellos con enfermedades de base, en lactantes en estado crítico y en prematuros. Como los probióticos son organismos vivos, existen riesgos potenciales de transferir resistencia a los antibióticos a las bacterias patógenas, de translocación intestinal y de desarrollo posterior de enfermedad sistémica y sepsis, de desarrollar acidosis D-láctica y la posibilidad de efectos adversos a largo plazo sobre la flora intestinal. El manejo adecuado y la administración de prebióticos y probióticos, así como el seguimiento riguroso de sus efectos potencialmente adversos serán esenciales para mejorar la seguridad en los niños.
Perspectivas
Desde el tiempo de Metchnikoff y su primera propuesta del concepto de probiótico, se han desarrollado un gran número de estudios para el uso de los mismos como alternativa a la medicina basada en la evidencia. A pesar de la alta heterogeneidad de los probióticos utilizados en los estudios, la evidencia acumulada apoya el importante papel de los pro y prebióticos en el mantenimiento y la promoción de la salud humana. El diseño y la calidad de los estudios deben mejorar, así como el riguroso control de la seguridad y de las complicaciones potencialmente infecciosas cuando se sugiere la adición de bacterias vivas en alimentos para niños. Además, el control de calidad de los procesos de fabricación y las injustificadas declaraciones de las propiedades saludables de los probióticos y prebióticos siguen siendo cuestiones importantes. Recientemente, la FDA de los EE.UU (Food and Drug Administration) clasificó claramente a los probióticos como "drogas" cuando se aplica para "prevenir, tratar o mitigar la enfermedad", y dentro de la Unión Europea, las declaraciones de propiedades saludables de alimentos funcionales y suplementos son críticamente revisados por las autoridades de la Comisión Europea de Seguridad Alimentaria.
Queda por ver cómo estos desarrollos normativos influirán en el compromiso del fabricante y la investigación científica. Los enfoques metagenómicos y genómicos influirán de forma sustancial la comprensión de la interacción y de la co-evolución de los microbios beneficiosos y del huésped. La investigación básica y los estudios clínicos no solo deben centrarse en los probióticos, sino también en el papel de los agentes no viables, como prebióticos y factores probióticos solubles.
Comentario: Es claro el aumento de la difusión que sugiere el uso de alimentos suplementados con pre y/o probióticos, refiriendo sus beneficios y tentando al uso masivo de los mismos. Este estudio muestra un abordaje profundo a través de la revisión sistemática de estudios aleatorizados y controlados más datos publicados en Cochrane.
Si bien faltaría establecer lineamientos unificados de trabajo en poblaciones más homogéneas y comparables, da un enfoque orientado sobre el papel real que juegan los prebióticos, probióticos y simbióticos en la prevención de ciertas patologías infecciosas en los niños.
Serán necesarios más estudios para corroborar los interesantes datos planteados en esta revisión.
No obstante, con el aumento del número de estudios bien conducidos, está creciendo la evidencia a favor o en contra del uso de pro y prebióticos. Este artículo se centra en la evidencia de los beneficios clínicos de los prebióticos, probióticos y simbióticos para la prevención y tratamiento de enfermedades infecciosas en pediatría.
Definiciones y justificación para su uso
Los probióticos son microorganismos vivos que cuando se administran en dosis adecuadas, confieren un beneficio para la salud del huésped. Por el contrario, los prebióticos son alimentos no digeribles que afectan beneficiosamente al huésped mediante la estimulación selectiva del crecimiento y/o actividad de un número limitado de bacterias en el colon. Los simbióticos son la combinación de los probióticos y prebióticos.
La justificación del uso de los probióticos se basa principalmente en su capacidad de remodelación de las colonias microbianas, y por lo tanto de promover el crecimiento y la sobrevida de bacterias comensales en favor del sobrecrecimiento de bacterias patógenas. Además, ejercen funciones inmunomoduladoras, influyen y promueven in vitro la diferenciación de células epiteliales, la proliferación y la función de la barrera intestinal.
Los prebióticos comercializados se desarrollaron con éxito para imitar los efectos de los oligosacáridos encontrados en la leche materna. Se utilizan selectivamente para promover la colonización, el crecimiento, la sobrevida y la función de las bacterias comensales, y posiblemente modular el sistema inmune. Debido a sus diferencias estructurales con los oligosacáridos de la leche materna, pueden carecer de la capacidad para promover beneficios de salud adicionales más allá de su función prebiótica.
Prevención de las enfermedades infecciosas en general
En un estudio observacional reciente (771 lactantes), se observó que el grupo que recibió una fórmula de continuación suplementada con simbióticos tuvo significativamente menos enfermedades infecciosas (EI) en general en comparación con el grupo control (31,0% vs. 40,6%, P <0,05), mientras que en el análisis para EIs específicas sólo la frecuencia de las infecciones gastrointestinales mantuvo diferencias significativas (3,5% vs. 6,8%, P = 0,03). Un estudio randomizado y controlado (ERC) demostró una disminución del 30% en el número total de EIs en el grupo con probióticos en comparación con el grupo control (razón de la tasa de incidencia: 0,70; P = 0,003). No hubo efectos sobre el total de episodios febriles entre el grupo de intervención y el control en este estudio. Van Stuijven¬berg y colaboradores investigaron específicamente el impacto de los prebióticos sobre los episodios febriles durante el primer año de vida, pero no pudieron demostrar una reducción en el grupo de intervención. En un estudio reciente se demostró que durante el periodo de intervención (0-6 meses), un menor número de niños recibieron antibióticos en el grupo con simbióticos en comparación con el grupo placebo (23% vs. 28%; odds-ratio: 0,74 [Intervalo de confianza del 95% [IC 95%]: 0.55-1.00], P <0,049). En contraste, los autores no observaron diferencias en el consumo de antibióticos durante el periodo de seguimiento (6-24 meses). Queda por verse si los posibles efectos beneficiosos de los probióticos sobre las EIs en general pueden confirmarse en nuevos estudios, o si estos efectos pueden atribuirse a la reducción de EIs específicas.
Infecciones respiratorias
Un ERC (571 niños, 1-6 años de edad) no mostró diferencias en la ocurrencia de otitis media (OM) entre el grupo de intervención que utilizó Lactobacillus rhamnosus GG (LGG) y el grupo control (72% vs. 65%, OR = 1,48 [IC 95%: 0.87- 2,52]) durante los 7 meses del periodo de estudio, pero mostró diferencias hacia una menor incidencia de infecciones del tracto respiratorio superior (ITRS) recurrentes (≥ 4) (OR = 0,56 [IC 95%: 0,31-0,99]). Se hallaron resultados opuestos para la incidencia de OM en un estudio de 72 lactantes (<2 meses de edad, en seguimiento hasta los 12 meses), que recibieron LGG y Bifidobacterium lactis o placebo. Durante los primeros 7 meses de vida, los niños del grupo de intervención experimentaron significativamente menos episodios de OM en comparación con el grupo control (22% vs. 50%, riesgo relativo [RR]: 0,44 [IC 95%: 0,21-0,90], P = 0,014). El grupo con probióticos también tuvo menos infecciones respiratorias recurrentes en el primer año de vida (28% vs. 55%; RR: 0,51 [IC 95%: 0,27-0,95], P = 0,022).
En un ERC basado en población, los investigadores pudieron demostrar una reducción del 24% en la incidencia de neumonía (IC 95%: 0-42%; P = 0,05), y del 35% en la incidencia de infección aguda severa del tracto respiratorio inferior (IC 95%: 0-58%; P = 0,05) en el grupo de intervención con simbióticos en comparación con el grupo control.
Maldonado y colaboradores demostraron una reducción del 27% en la tasa de incidencia de ITRS en niños del grupo de intervención en comparación con el grupo control durante el período de estudio (razón de la tasa de incidencia: 0,729, P = 0,026), pero no encontraron diferencias en la tasa de incidencia de OM o de infección del tracto respiratorio inferior. Los datos analizados a partir de 10 ERC (incluyendo 8 estudios que involucraron niños) a partir de una revisión sistemática reciente de Cochrane demostraron que los probióticos fueron mejores que el placebo con respecto a la incidencia de ITRS. No obstante, la heterogenicidad de los datos y la variada calidad de los estudios limitaron las recomendaciones basadas en la evidencia para el uso generalizado de los probióticos para prevenir infecciones respiratorias.
Los datos sobre prebióticos en este aspecto son escasos. Los lactantes que recibieron leche de fórmula suplementada con una mezcla de galactooligosacáridos y fructooligosacáridos durante los primeros 6 meses de vida tuvieron un menor riesgo de ITRS (14/102 vs. 30/104; RR: 0,5 [IC del 95%: 0.3-0.8]), y una tasa reducida de infecciones recurrentes del tracto respiratorio (3% vs. 10%; RR: 0,3 [IC 95%: 0,09-0,99]), pero presentaron incidencias similares de OM en comparación con los niños del grupo control alimentados con fórmula no suplementada.
Prevención de diarrea aguda
Una revisión sistemática reciente de ERCs para probióticos en niños sólo mostró un modesto beneficio para la prevención de la diarrea aguda en niños sanos. Los resultados de tres estudios agrupados, en los que la cepa más frecuentemente utilizada fue B. lactis, mostraron una reducción significativa del riesgo de infecciones gastrointestinales (3 ECA; n = 302; RR: 0,54 [IC 95%: 0,36-0,81]).
Por lo tanto, el Comité de Nutrición de la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica refirió que existe alguna evidencia a partir de los estudios agrupados para apoyar el suplemento de las fórmulas infantiles con B. lactis (solo o en combinación) para reducir el riesgo de infecciones gastrointestinales no específicas en los niños.
Un meta-análisis reciente de 3 ERCs (más de 1000 niños) que investigó la prevención de la diarrea asociada al sistema de salud mediante la adición de leche fermentada suplementada con LGG (o LGG en cápsulas o sobres), mostró tasas significativamente más bajas de diarrea y gastroenteritis sintomática por rotavirus en el grupo de intervención en comparación con el grupo control (RR: 0,37 [IC 95%: 0,23-0,59] y RR: 0,49 [IC 95%: 0,28-0,86], respectivamente).
Para prevenir un caso de diarrea nosocomial, 12 niños deberían ser tratados con LGG (número necesario a tratar = 12). Como este meta-análisis solo se centró en LGG, se debe ser cauteloso al extrapolar estos hallazgos para otros probióticos. En contraste, los resultados a partir de un ERC realizado recientemente utilizando otra cepa de lactobacilo (L. reuteri DSM 17938) no mostraron diferencias en la prevención de la diarrea nosocomial. En general, parece acumularse evidencia creciente de que los probióticos pueden prevenir las infecciones gastrointestinales nosocomiales en niños sanos, pero existe menos evidencia sobre la prevención de infecciones gastrointestinales en la comunidad y en guarderías. Debe destacarse que en una revisión reciente de la Academia Americana de Pediatría, los autores señalan con razón el hecho de que la vacuna contra el rotavirus es probablemente más efectiva en la prevención de la diarrea infecciosa aguda infantil que el uso de probióticos.
Tratamiento de la diarrea aguda
El papel de los probióticos en el tratamiento de la gastroenteritis aguda (viral) en lactantes y niños ha sido investigado en múltiples ensayos clínicos, lo que llevó a las recomendaciones dadas por la Sociedad Europea de Gastroenterología, Hepatología, y Nutrición Pediátrica y por la Sociedad Europea de Enfermedades Infecciosas Pediátricas que seleccionaron probióticos con eficacia clínica probada y que, administrados en dosis adecuadas según la situación y la población de pacientes, podrían ser utilizados como complemento de la terapia de rehidratación en el manejo de la gastroenteritis aguda (viral) en niños. En una revisión sistemática de Cochrane publicada recientemente, que incluyó 56 estudios con niños, los autores concluyen que los probióticos tienen claros efectos beneficiosos en el acortamiento de la duración de la diarrea infecciosa aguda con una media de 24,76 horas (IC del 95%: 15.9-33.6 horas; 35 ensayos; > 4500 participantes) y en la reducción de la frecuencia media de las deposiciones al 2°día (diferencia media 0,8; 0,45-1,14; 20 ensayos, > 2700 participantes). Los resultados de un meta-análisis actualizado de ERCs que investigó el impacto de Saccharomyces boulardii en la tratamiento de la gastroenteritis aguda (viral) en niños también demostraron una reducción en la duración de la diarrea con una mediana de 1,08 días (IC 95%: -1,64 a -0,53); 5 ERCs; 944 participantes) en el grupo de intervención con probióticos en comparación con el grupo control.
Es interesante observar que S. boulardii en combinación con metronidazol demostró también ser útil para disminuir la duración de la diarrea con sangre en niños con amebiasis en comparación con metronidazol solo (42,2 ± 17,4 horas vs. 72,0 ± 28,5 horas; P <0,001). En este contexto, también se demostró recientemente que los oligosacáridos de la leche materna, que sirven como modelo para los prebióticos sintetizados artificialmente similares a galactooligosacáridos y fructooligosacáridos, disminuyen la unión y la citotoxicidad de Entamoeba histolytica en un modelo de cultivo celular humano. Como nota, en el mismo escenario podrían ocurrir efectos similares con los galactooligosacáridos.
Diarrea asociada a antibióticos
En la mayoría de los ERCs publicados, los probióticos se administraron en paralelo con los antibióticos iniciados (más frecuentemente para el tratamiento de infecciones respiratorias agudas). Un meta-análisis de 6 ERCs mostró como resultados una reducción del riesgo de desarrollar diarrea asociada a antibióticos del 28,5% al 11,9% (RR: 0,44 [IC 95%: 0,25-0,77]; P = 0,006; número necesario a tratar = 7). Una revisión sistemática Cochrane recientemente publicada también demostró que altas dosis de prebióticos tuvieron un efecto protector, con prevención de la diarrea asociada a antibióticos en los niños tratados en comparación con el placebo (prevalencia del 8% vs. 22%, RR: 0,40 [IC 95%: 0,29-0,55]; número necesario a tratar = 7). Como muchos estudios investigaron simbióticos, los datos son escasos para los efectos de los prebióticos solamente.
Un estudio reciente sobre gastroenteritis viral en niños no pudo mostrar diferencias entre el grupo de intervención (oligofructosa e inulina) y el grupo control. A diferencia de los adultos, los efectos terapéuticos de los probióticos en la diarrea asociada a antibióticos, o en la diarrea asociada a Clostridium difficile no han sido investigados en ERCs.
Gastritis por Helicobacter pylori
Aunque existe evidencia creciente en los ERCs, especialmente en adultos, que los probióticos en combinación con la triple terapia (2 antibióticos y un inhibidor de la bomba de protones) pueden erradicar el H. pylori con mayor eficacia en comparación con la triple terapia sola (tasa de erradicación con un aumento en torno al 10%), los resultados en niños no son concluyentes.
Enterocolitis necrotizante
Los autores no focalizan esta revisión en la enterocolitis necrotizante (ECN); sin embargo, es probable que la infección desempeñe un rol en alguna etapa de la patogénesis de la ECN, aunque las interacciones exactas aún deben ser dilucidadas.
Cabe señalar que el debate actual sobre los pros y contras del rol de los probióticos en la prevención de la ECN demuestra las dificultades en la traducción de los resultados de estudios heterogéneos en recomendaciones basadas en la evidencia (y en cambios en las prácticas). En este sentido, la gravedad de los resultados de los estudios, es decir, la reducción de la mortalidad global y de la incidencia de ECN en alrededor del 50% en los lactantes que recibieron probióticos, hace que los autores tiendan a creer que no es ético negar un tratamiento que podría salvar la vida, por la realización de estudios multicéntricos, placebo/controlados. Se planteó la pregunta acerca de cuantas pruebas serían necesarias antes de cambiar las prácticas.
Sepsis
Aunque los resultados de estudios individuales podrían sugerir un efecto beneficioso o perjudicial de la administración de probióticos para prevenir la sepsis confirmada por cultivo en lactantes, los datos de los metaanálisis no confirmaron esta asociación.
Mihatsch y colaboradores investigaron si los probióticos podrían ser de utilidad en la prevención de infecciones nosocomiales en un grupo de riesgo vulnerable, los lactantes de muy bajo peso al nacer (183 niños; < 1500 gramos o menores de 30 semanas de edad gestacional). Cuando se administró B. lactis, no se pudieron demostrar diferencias en la incidencia de infecciones nosocomiales en niños de muy bajo peso al nacer, ni efectos adversos en comparación con el grupo control. Un estudio randomizado, que investigó el papel de los probióticos en la prevención de la colonización por Cándida y de la sepsis de inicio tardío, no mostró diferencias en la infección invasiva por Cándida entre el grupo de intervención y el control.
Infecciones urogenitales
Los datos de los ERCs han demostrado que no disminuyó la incidencia de las infecciones del tracto urinario (ITU) en niños que recibieron probióticos. Por otra parte, la intervención simbiótica o prebiótica no se tradujo en una menor incidencia de ITU. Es interesante notar que un estudio prospectivo demostró una incidencia similar de ITU con probióticos y con profilaxis convencional con antibióticos en niños con reflujo vesicoureteral primario persistente (18,3% [11/60] vs. 21,6% [13/60], P = 0,962). Además, la cicatrización renal no fue significativamente diferente entre los dos grupos. Si cualquier medicación "biótica" es necesaria para la prevención de las infecciones urinarias es tema para otro debate.
Infección por VIH
La transmisión vertical del VIH se incrementa 3 veces en mujeres VIH-positivas con vaginosis bacteriana. Se piensa que los probióticos influirían favorablemente la flora vaginal alterada, y los diferentes regímenes terapéuticos prometen rendir resultados. Por lo tanto, los probióticos podrían tener un impacto indirecto sobre los niños infectados por VIH. Es interesante notar que se ha demostrado que los prebióticos naturales, los oligosacáridos de la leche humana, interactúan competitivamente con el VIH por los sitios de unión al receptor in vitro.
Seguridad
En la actualidad, no existen problemas de seguridad para el uso de prebióticos y probióticos en niños sanos. Se requiere evaluación de riesgos críticos en los niños inmunosuprimidos y en aquellos con enfermedades de base, en lactantes en estado crítico y en prematuros. Como los probióticos son organismos vivos, existen riesgos potenciales de transferir resistencia a los antibióticos a las bacterias patógenas, de translocación intestinal y de desarrollo posterior de enfermedad sistémica y sepsis, de desarrollar acidosis D-láctica y la posibilidad de efectos adversos a largo plazo sobre la flora intestinal. El manejo adecuado y la administración de prebióticos y probióticos, así como el seguimiento riguroso de sus efectos potencialmente adversos serán esenciales para mejorar la seguridad en los niños.
Perspectivas
Desde el tiempo de Metchnikoff y su primera propuesta del concepto de probiótico, se han desarrollado un gran número de estudios para el uso de los mismos como alternativa a la medicina basada en la evidencia. A pesar de la alta heterogeneidad de los probióticos utilizados en los estudios, la evidencia acumulada apoya el importante papel de los pro y prebióticos en el mantenimiento y la promoción de la salud humana. El diseño y la calidad de los estudios deben mejorar, así como el riguroso control de la seguridad y de las complicaciones potencialmente infecciosas cuando se sugiere la adición de bacterias vivas en alimentos para niños. Además, el control de calidad de los procesos de fabricación y las injustificadas declaraciones de las propiedades saludables de los probióticos y prebióticos siguen siendo cuestiones importantes. Recientemente, la FDA de los EE.UU (Food and Drug Administration) clasificó claramente a los probióticos como "drogas" cuando se aplica para "prevenir, tratar o mitigar la enfermedad", y dentro de la Unión Europea, las declaraciones de propiedades saludables de alimentos funcionales y suplementos son críticamente revisados por las autoridades de la Comisión Europea de Seguridad Alimentaria.
Queda por ver cómo estos desarrollos normativos influirán en el compromiso del fabricante y la investigación científica. Los enfoques metagenómicos y genómicos influirán de forma sustancial la comprensión de la interacción y de la co-evolución de los microbios beneficiosos y del huésped. La investigación básica y los estudios clínicos no solo deben centrarse en los probióticos, sino también en el papel de los agentes no viables, como prebióticos y factores probióticos solubles.
Comentario: Es claro el aumento de la difusión que sugiere el uso de alimentos suplementados con pre y/o probióticos, refiriendo sus beneficios y tentando al uso masivo de los mismos. Este estudio muestra un abordaje profundo a través de la revisión sistemática de estudios aleatorizados y controlados más datos publicados en Cochrane.
Si bien faltaría establecer lineamientos unificados de trabajo en poblaciones más homogéneas y comparables, da un enfoque orientado sobre el papel real que juegan los prebióticos, probióticos y simbióticos en la prevención de ciertas patologías infecciosas en los niños.
Serán necesarios más estudios para corroborar los interesantes datos planteados en esta revisión.
Administración de probioticos en la vida temprana atopía y asma
Meta-análisis para evaluar el efecto de probióticos en la incidencia de asma y atopía.
Autor: Dres. Nancy Elazab, Angelico Mendy, Janvier Gasana, Edgar R. Vieira, Annabelle Quizon and Erick Forno. Pediatrics 2013; 132; e666
La prevalencia mundial de enfermedades alérgicas tales como el asma, la dermatitis atópica, y la rinoconjuntivitis alérgica es significativa y se ha incrementado en las últimas décadas. Actualmente, se estima que un 20% de la población mundial sufre de algún tipo de trastorno alérgico. La hipótesis de la higiene, formulada como un probable explicación para el aumento de la prevalencia de las enfermedades alérgicas, sugiere que el aumento de la limpieza, la reducción del tamaño de la familia, y la disminución de las infecciones en la infancia han disminuido la exposición a los microbios, que desempeñan un papel crucial en la maduración del sistema inmune del huésped durante los primeros años de vida.
La flora microbiana intestinal, o microbioma, puede contribuir a la patogénesis de las enfermedades alérgicas debido a su efecto sustancial sobre la inmunidad de la mucosa. La exposición a una flora microbiana normal temprano en la vida permite un cambio en el equilibrio de linfocitos T helper 1 (Th1) / linfocitosT -helper 2 (Th2), favoreciendo la respuesta de células Th1. Las enfermedades atópicas, por el contrario, implican respuestas Th2 a alérgenos; las respuestas alérgicas anormales se cree que surgen en ausencia de un microbioma intestinal normal mientras que el sistema inmunológico está todavía en desarrollo, produciendo un cambio en el balance de citoquinas Th1/Th2 hacia una respuesta Th2, y una activación consecuente de citoquinas Th2 tales como la Interleuquina (IL)-4, IL-5 e IL-13, así como una mayor producción de inmunoglobulina (Ig) E.
Los probióticos, definidos como "microorganismos vivos, que, cuando se administran en cantidades adecuadas, confieren un beneficio de salud para el huésped" por la Organización Mundial de la Salud, potencialmente pueden modular la respuesta inmune, lo que resulta en la estimulación de citoquinas Th1 que pueden suprimir las respuestas Th2. Por lo tanto, varios estudios fueron diseñados para examinar la eficacia de los probióticos en muchos trastornos alérgicos. Sin embargo, los resultados en la atopía y el asma han sido contradictorios, y varios de estos informes pueden no haber tenido el poder suficiente. En el presente estudio, los autores realizaron un meta-análisis de estudios aleatorizados controlados para determinar si la administración de probióticos durante el embarazo y/o después del nacimiento disminuye la incidencia de atopía y asma en niños pequeños en comparación con el placebo.
Métodos
Se registra un protocolo del meta-análisis en PROSPERO (Registro Número: 42013004176) (http://www.crd.york.ac.uk/PROSPERO/display_record.asp?ID=CRD4201300416 ).
Fuentes de datos
Se realizaron búsquedas en Medline, Highwire, Web de Conocimiento, en el Índice Acumulativo de Literatura sobre Salud y Enfermería, y en el Registro Central Cochrane de Ensayos Controlados de estudios aleatorizados que evaluaran el efecto de la suplementación con probióticos en las enfermedades alérgicas en niños hasta marzo de 2013.
En todas las bases de datos se utilizaron las siguientes palabras claves: "probióticos" en asociación con "asma", "sibilancias", "rinitis", “atopía", "alergia", "inmunoglobulina", "IgE", "sensibilización", o "eczema". En Medline, los autores realizaron la búsqueda en base a los siguientes términos médicos: Probiótico Y (Asma o Sibilancias o Rinitis o Fiebre del Heno o Atopía o Alergia o Inmunoglobulina o IgE o Sensibilización o Eczema). La búsqueda se limitó a niños utilizando los límites "Humanos" y "Niño: nacimiento – 18 años". Además, los autores evaluaron manualmente las referencias de los artículos seleccionados para buscar estudios adicionales pertinentes.
Selección de los estudios
Todos los estudios recuperados de las diferentes bases de datos utilizando las estrategias de búsqueda antes mencionadas fueron derivados a un programa de gestión de referencia con base Web (Refworks [Pro-Quest, Ann Arbor, MI]), con eliminación de los duplicados. Los estudios sobre probióticos que cumplían con los siguientes criterios predefinidos se incluyeron en el meta-análisis.
Diseño del estudio
Se incluyeron estudios doble ciego, aleatorizados, controlados con placebo, publicados en inglés (o en otros idiomas aparte del inglés, cuando existía la posibilidad de traducirlos al inglés mediante el uso de servicios de traducción en línea). La randomización se consideró adecuada cuando un estudio se describió como aleatorizado, incluso si el método preciso de aleatorización no fuera informado. Los ensayos fueron incluidos si la intervención (suplementación con probióticos) estaba dirigida hacia el niño y/o la madre embarazada. Se consideraron los estudios cruzados sólo si el análisis era realizado por separado para la primera mitad del estudio, y los resultados estaban disponibles.
Población
Se incluyeron niños en los que se midieron resultados entre el nacimiento y los 18 años de edad, sin antecedentes de enfermedades atópicas al momento de la suplementación con probióticos. Los niños con enfermedades atópicas fueron considerados sólo para el resultado "IgE total".
Intervención
Se evaluaron los probióticos bacterianos (única cepa o mezclas) administrados antes del nacimiento y/o luego del mismo durante el primer año de vida para la prevención de las enfermedades atópicas. El uso de los probióticos después del primer año de vida sólo se consideró para el resultado "IgE total", al evaluar el efecto de los probióticos en la IgE total de niños atópicos y no atópicos.
Control
Los sujetos control fueron niños que recibieron un placebo.
Resultados
Los resultados incluyeron el nivel de IgE total, la sensibilización atópica y asma/sibilancias. Se midieron los niveles de IgE total mediante el uso de inmunoensayo. La sensibilización atópica se definió como un resultado positivo en una prueba cutánea (PC) y/o una IgE específica elevada (> 0.35 KU/L) frente a cualquier alimento o alérgeno inhalante. Cuando los datos fueron informados por separado como PC positiva o IgE elevada, se seleccionaron los datos de las PCs positivas. Se definió como asma/sibilancias al informe de los padres del diagnóstico médico o al diagnóstico directo por un profesional participante en el ensayo.
Dos autores evaluaron de forma independiente todas las referencias de acuerdo con los criterios de selección. La selección inicial después de la eliminación de duplicados se basó en la evaluación del título y el resumen, y la selección final fue realizada utilizando los textos completos. Los criterios de exclusión fueron: (1) diseño del estudio no elegible (por ejemplo, estudios controlados con placebo no aleatorizados, estudios observacionales, estudios cruzados sin un análisis por separado de la primera mitad); (2) población no elegible (por ejemplo, estudios en animales, estudios incluyendo adultos > 18 años); (3) intervención no elegible (por ejemplo, administración de productos distintos a los probióticos o asociación de probióticos con otros productos tales como prebióticos); (4) resultados no elegibles, que incluyeran otros resultados distintos a los de las enfermedades alérgicas.
En la selección final, basada en la evaluación del texto completo, los criterios para la exclusión fueron la intervención o los resultados no elegibles (estudio sobre enfermedades alérgicas que no incluyera datos sobre el asma, las sibilancias, la IgE total, o la sensibilización atópica después del seguimiento). Cuando fue posible, los autores que midieron los resultados de interés después del seguimiento pero que los no informaron fueron contactados para obtener información adicional. Las diferencias de opinión para la inclusión se resolvieron mediante acuerdo.
Extracción de los datos
Utilizando un formulario de extracción de datos uniforme, dos de los autores recuperaron de forma independiente y a partir de los artículos de texto completo los datos de referencia (primer autor, año de publicación), el momento de suplementación con probióticos (prenatal y/o después del parto), la cepa de probiótico administrada, la dosis y la duración de la suplementación, la edad de los participantes al inicio y al final del seguimiento, las definiciones de resultado, el número total de participantes, el número de participantes y de casos en los grupos de intervención y control, los niveles medios de IgE total y el desvío estándar (DE) o intervalo de confianza (IC) correspondiente. Cuando los estudios usaron la misma población, se conservó aquel con el seguimiento más largo en el tiempo para el análisis apropiado. Los desacuerdos en la extracción de datos entre los 2 autores se resolvieron mediante discusión mutua y, ante la necesidad, por consulta con un tercer autor.
El acuerdo entre los revisores en la selección de los estudios se determinó mediante el uso de la estadística k de Cohen (k).
Evaluación de la calidad
La calidad metodológica de los ensayos clínicos aleatorios individuales se evaluó utilizando la escala de Jadad. Esta se calcula utilizando 3 ítems que evalúan la asignación al azar, el cegamiento y las discontinuaciones, lo que resulta en una puntuación total entre 0 (calidad más baja) y 5 (mayor calidad). Puntajes de 3 a 5 fueron considerados como de alta calidad.
Análisis
Los datos recogidos se combinaron para generar estimaciones resumidas, y cada estudio se ponderó por el tamaño de efecto de su varianza inversa. Para evaluar el efecto de los probióticos, se calcularon los riesgos relativos (RRs) para el desarrollo de asma y sensibilización atópica y se ponderaron las diferencias medias (DMP) para la IgE total entre los grupos intervención y control, utilizando los métodos de efectos aleatorios de DerSimonian y Lair. El análisis de efectos aleatorios no sólo pondera cada estudio por su varianza inversa sino que también incluye las variaciones dentro de- y entre estudios; es más conservador que los modelos de efectos fijos, proporcionando IC mayores cuando existe heterogeneidad entre estudios. Se evaluó la heterogeneidad en los resultados entre los estudios utilizando estadística Q de Cochran. Dada la baja potencia de la prueba, el nivel de significación fue definido como P < 0.10. El I2 se utilizó para cuantificar el alcance de la verdadera heterogeneidad. Se realizó una evaluación del sesgo de publicación con la prueba de Egger, en base a un gráfico en embudo y a la regresión de la estimación del efecto estandarizado como una medida de precisión.
Se llevaron a cabo análisis de subgrupos según el tiempo de administración de los probióticos, el grupo de edad, la definición de resultado (PC o IgE específica elevada para la sensibilización atópica, asma o sibilancias para asma/sibilancias), y análisis de meta regresión para explorar las posibles fuentes de heterogeneidad y evaluar los efectos de diferentes factores tales como la cepa probiótica (s), la edad basal de los participantes, la dosis administrada, la duración de la suplementación, y la duración del seguimiento de la eficacia de los probióticos, así como la suplementación materna con probióticos durante la lactancia frente a la suplementación directa del lactante. Todos los análisis se realizaron con Stata versión 11 (StataCorp, College Station, TX) y un valor de P de 0,05 se consideró estadísticamente significativo.
Resultados
Se identificaron un total de 1081 artículos: 355 artículos de PubMed, 44 del Índice Acumulativo, 518 de la Web de Conocimiento, 73 de Highwire y 91 del Registro Central de Cochrane. De éstos, 25 estudios fueron incluidos en el meta-análisis para 20 cohortes con un total de 4.031 participantes. Hubo acuerdo completo en 697 de los 778 artículos (después de la exclusión de duplicados) luego de la selección del título y el resumen (acuerdo entre autores: k = 79,2%) y en 62 de 68 artículos después de la revisión del texto completo (acuerdo entre autores: k = 81,8%).
Características de los estudios incluidos
Los estudios incluidos fueron publicados entre 2001 y 2012. Los ensayos fueron realizados principalmente en Europa, pero también en Asia, Australia, y Nueva Zelanda. Los probióticos se administraron prenatalmente (en mujeres embarazadas) en 2 ensayos, prenatalmente a mujeres embarazadas y en el periodo postnatal directamente a los niños en 10 ensayos, y sólo después del nacimiento a los niños en 9 estudios. Diez ensayos utilizaron Lactobacillus, y 8 utilizaron mezclas de probióticos. Wickens y col., Rautava y col., y Gore y col. utilizaron brazos separados de Lactobacillus y Bifidobacterium en comparación con un grupo placebo. Todos menos 2 estudios tenían una puntuación de Jadad de 3 a 5 y fueron considerados de buena calidad metodológica.
La sensibilización atópica se definió por una PC positiva y/o un nivel de IgE > 0.35 KU/L ante cualquier alimento o alérgeno inhalante (por ejemplo gatos, perros, ácaros, clara de huevo, leche de vaca, maní, polen de abedul, hierba o pasto) en la mayoría de los estudios que evaluaron sensibilización atópica. Uno evaluó solamente alérgenos alimentarios y otro sólo alérgenos inhalantes. El diagnóstico de asma/sibilancias sólo fue reportado por los padres mediante un cuestionario, y en 5 estudios, verificado por un médico, enfermera o por un registro de medicación para el asma.
Algunos estudios utilizaron las mismas poblaciones: Kalliomäki y col. incluyeron una cohorte de 159 madres reclutadas en Finlandia en 3 estudios; 3 estudios analizaron una cohorte de 231 mujeres embarazadas atópicas de Australia, y Wickens y col. se centraron en 223 mujeres embarazadas de Kiwi que bien ellas o los padres de sus bebés eran atópicos en 2 estudios. Sin embargo, estas cohortes fueron incluidas sólo una vez en los diferentes análisis (el informe más reciente de cada caso).
IgE sérica total
Nueve estudios representando cohortes de 9 ensayos fueron incluidos (1.103 niños). En general, los probióticos fueron efectivos en la reducción de la IgE total (DMP:-7,59 U/ml [IC 95%: -14,96 a -0,22], P =0,044), sin heterogeneidad significativa entre los estudios (I2 nula, prueba Q de Cochran, P = 0,573). En los análisis de subgrupos, el efecto de los probióticos en la IgE total fue significativo entre los niños con atopía (DMP: -35,12 U/ml [IC 95%: -69,82 a -0,42], P = 0,047) pero no en los niños no atópicos con antecedentes familiares. Por edad, el efecto de los probióticos fue significativo en niños ≥ 2 años de edad (DMP: -12,74 U/ml [IC 95%: -24,55 a -0,93]; P = 0,035).
Los análisis de meta-regresión multivariados, que incluyeron la edad de referencia, la edad al seguimiento, el sexo, la duración del tratamiento, la dosis diaria y total, y la duración del seguimiento, mostraron que la duración del seguimiento modificó el efecto de los probióticos en la IgE total: la reducción en la IgE fue más pronunciada con el seguimiento más prolongado (coeficiente de correlación [β]: -1,95 [IC 95%: -3,69 a -0,21], P = 0,028). El gráfico en embudo y la prueba de Egger no mostraron evidencia de sesgo de publicación (P = 0,23).
Sensibilización atópica
Se incluyeron veintiún estudios que caracterizaron 14 ensayos (N = 2.797). En general, los probióticos tuvieron un efecto parcialmente significativo en la reducción del riesgo de sensibilización atópica, definida como un resultado positivo en la PC y/o una IgE específica elevada (RR: 0,90 [IC 95%: 0,80 a 1,00], P = 0,060). La reducción fue significativa cuando los probióticos se administraron prenatalmente y después del nacimiento (RR: 0,88 [IC 95%: 0,78-0,99], P = 0,035), pero no cuando se dieron sólo después del nacimiento (P = 0,825).
El análisis de subgrupos por definición de sensibilización atópica mostró un efecto protector significativo de los probióticos contra un resultado positivo en la PC a alérgenos comunes cuando se administraron prenatalmente y después del nacimiento (RR: 0,86 [IC 95%: 0,75 a 0,98], P = 0,027).
El efecto protector global contra la sensibilización atópica fue cercano a la significación (RR: 0,88 [IC 95%: 0,78 a 1,00], P =0,059) cuando se definió como un resultado positivo en la PC pero no fue significativo cuando se definió como un nivel elevado de IgE específica.
La meta-regresión multivariada mostró que la administración de Lactobacillus acidophilus se asoció con un aumento del riesgo de sensibilización atópica (β: 0,45 [IC 95%: 0,16 a 0,74], P = 0,002). El gráfico en embudo y la prueba de Egger no mostraron evidencia de sesgo de publicación (P = 0,57).
Asma/sibilancias
Se incluyeron catorce estudios a partir de 10 ensayos (n = 3143). Los probióticos no redujeron significativamente la presencia de asma/sibilancias (RR: 0,96 [IC 95%: 0,85 a 1,07]). No se encontró asociación significativa en los análisis de subgrupos por grupos de edad, duración del tratamiento, duración del seguimiento, cepa de probiótico, dosis administrada, o definición de resultado (sibilancias alguna vez, asma/sibilancias recurrentes, asma/sibilancias por atopía). El gráfico en embudo y la prueba de Egger no mostraron evidencia de sesgo de publicación (P = 0,25).
Discusión
Los resultados de este meta-análisis indican que la administración de probióticos temprano en la vida es eficaz en la reducción de los niveles de IgE y del riesgo de sensibilización atópica en niños pequeños, pero no del riesgo de asma o sibilancias. No hubo ninguna diferencia basada en la duración de la administración (prenatalmente a las madres y luego en el periodo post-natal en comparación con sólo después del nacimiento) con respecto a la IgE, pero la disminución en el riesgo de atopía fue significativa sólo cuando la administración de probióticos se inició durante el embarazo y continuó después del nacimiento. Los resultados del análisis de meta-regresión mostraron que el efecto de los probióticos en la disminución del nivel de IgE total fue más pronunciado en los períodos de seguimiento más largos, y que su efecto en la disminución del riesgo de sensibilización atópica puede depender de las cepas específicas administradas.
Estos resultados son consistentes con la hipótesis de la higiene, que propone que la falta relativa de exposición microbiana durante la lactancia y la primera infancia puede dar lugar a un desequilibrio entre las respuestas inmunes de tipo Th1 y Th2 y puede inducir el desarrollo de respuestas alérgicas mediadas por IgE. Se ha postulado que la exposición temprana a bacterias comensales juega un papel crucial en la polarización Th1/Th2 y en la maduración de mecanismos regulatorios inmunes adecuados. El intestino es la fuente más importante de estimulación microbiana postnatal del sistema inmune, y los niños atópicos pueden tener diferente microbioma intestinal en comparación con sus pares no atópicos; se han encontrado tales diferencias entre los casos de eczema y los controles sanos, así como entre países con alta y baja incidencia de enfermedades atópicas. La administración de probióticos a temprana edad puede promover un microbioma intestinal saludable, que a su vez modula la maduración de la respuesta inmune.
Los trastornos alérgicos se asocian con un desplazamiento del equilibrio de citoquinas Th1/Th2 hacia una respuesta Th2. Esta acción conduce a la activación de citoquinas Th2 tales como IL-4, IL-5 e IL-13, así como a una mayor producción de IgE. Los probióticos pueden modular los receptores tipo toll y las proteínas de reconocimiento de proteoglicanos de los enterocitos, lo que lleva a la activación de las células dendríticas y a una respuesta Th1; la estimulación resultante de las citoquinas Th1 puede suprimir las respuestas Th2. Los estudios pediátricos sugieren que el uso de probióticos en niños con trastornos atópicos, tales como alergias a los alimentos o dermatitis atópica, resulta en la mejora de la producción de interferón-ˠ (una citoquina Th1), en la disminución de la IgE, y la disminución de la secreción de factor de necrosis tumoral-α inducida por antígeno, IL-5 e IL-10. En modelos animales de alergia inducida por ovoalbúmina (OVA), los probióticos (L acidophilus AD031 y Bifidobacterium lactis AD011) disminuyeron significativamente los niveles séricos de IgE OVA-específica, IgA, e IgG1; regulando hacia arriba al interferón-ˠ y la IL-10, y hacia abajo a la IL- 4.
Los probióticos también pueden prevenir la atopía vía inflamación sistémica o local de bajo grado: se han hallado concentraciones aumentadas de proteína C reactiva en niños con eczema y alergia a leche de vaca que fueron tratados con probióticos. Los mayores niveles de proteína C reactiva en niños con riesgo de alergia a los 6 meses de edad se asociaron con menor riesgo de eczema y enfermedad alérgica a los 2 años de edad después del tratamiento con probióticos en combinación con prebióticos. Los probióticos pueden inducir marcadores inflamatorios fecales, tales como α1-antitripsina, factor de necrosis tumoral α, y calprotectina, que han sido asociados con altos niveles de IgA fecal y un menor riesgo de enfermedad alérgica asociada a IgE, lo que sugiere que una inflamación intestinal mínima puede desempeñar un papel en su mecanismo de acción.
Aunque los análisis agrupados hallaron un efecto significativo de los probióticos sobre la IgE total y el riesgo de sensibilización atópica, no se encontró una significativa reducción del riesgo similar para el asma y las sibilancias, lo cual es consistente con estudios previos en adultos. Estudios en animales con probióticos han mostrado una disminución de la respuesta inflamatoria ante un desafío único a un alérgeno, pero no repetido: en modelos murinos de asma sensibilizados con OVA, la administración de Lactobacillus reuteri ATCC 23272, Lactobacillus rhamnosus GG o B. lactis Bb-12 disminuyó significativamente la hiperreactividad de las vías respiratorias y redujo la cantidad de células inflamatorias en el líquido de lavado broncoalveolar después del desafío con OVA intranasal. L. rhamnosus GG y B. lactis también aumentan las células T reguladoras naturales en los pulmones de ratones asmáticos. Sin embargo, MacSharry y col. informaron que la inhibición de ciertos componentes de la inflamación de la vía aérea inducida por alérgenos por la administración de Bifidobacterium longum fue superada después de la exposición repetida al alérgeno.
En base a los resultados del análisis de meta-regresión para la IgE y la sensibilización atópica, se especula que la falta de efecto de los probióticos en la reducción del riesgo de asma/sibilancias puede haber sido debido a las combinaciones específicas de cepas utilizadas en estos ensayos o debido a una longitud insuficiente de seguimiento; estas teorías tendrán que ser probadas prospectivamente. Los estudios en animales sugieren que los efectos de los probióticos sobre las respuestas de la vía aérea inducidas por alérgenos pueden ser sensibles al organismo utilizado: se ha demostrado que L. reuteri, pero no Lactobacillus salivarius, inhibe las respuestas alérgicas de las vías respiratorias en ratones sensibilizados, y un estudio reciente realizado por Hougee y col. demostró que Bacillus brevis tiene efectos inmunomoduladores dependientes de la cepa. La duración y el momento de la alimentación también son factores determinantes de la eficacia antiinflamatoria; Forsythe y col. hallaron que se requiere un periodo de alimentación de por lo menos 9 días para lograr una inhibición importante de la eosinofilia y de la hiperreactividad de las vías respiratorias en ratones. Para ser más eficaces, las especies bacterianas utilizadas como probióticos deben ser resistentes al ácido y a la bilis para sobrevivir y hacer el tránsito a través del tracto gastrointestinal superior, e incluso las cepas más resistentes pueden cultivarse en las heces por sólo 1 a 2 semanas después de la ingestión; por lo tanto, el consumo regular es vital.
Existen varias limitaciones potenciales en este estudio. Sólo se incluyeron artículos publicados en inglés o con resúmenes en inglés con información suficiente, lo que puede no ser representativo de todos los estudios realizados sobre el tema. Otra importante limitación en cualquier meta-análisis es la variabilidad entre estudios; aunque se utilizaron modelos de efectos aleatorios para tratar de tener en cuenta esta variabilidad y se realizaron análisis de meta-regresión para detectar efectos modificadores importantes, sólo se pueden analizar covariables que están disponibles a partir del manuscrito original. Por último, no se puede excluir completamente el riesgo de sesgo de publicación, aunque los gráficos en embudo y los análisis de la prueba de Egger no mostraron evidencia de tal sesgo para ninguno de los resultados.
Conclusiones
Los autores hallaron que la administración de probióticos en la vida temprana puede reducir la IgE total y proteger contra la sensibilización atópica pero no parece proteger contra el asma y las sibilancias. Por lo tanto, los probióticos seleccionados cuidadosamente y administrados durante el embarazo y la primera infancia pueden tener un papel en la prevención primaria de enfermedades atópicas, particularmente en lactantes de alto riesgo. Los ensayos futuros deberían considerar cepas específicas de probióticos, períodos de seguimiento más largos, y tal vez la asociación con oligosacáridos, particularmente cuando se evalúan los efectos de los probióticos en la reducción del riesgo de asma y sibilancias en el futuro.
Comentario
La prevalencia de las enfermedades alérgicas es significativa a nivel mundial, con diversas manifestaciones a nivel clínico. En este meta-análisis se destaca la importancia de los probióticos administrados prenatal como postnatalmente en la reducción de los niveles de IgE y de la sensibilización atópica. Se espera que los futuros estudios se explayen sobre los beneficios de la utilización de probióticos y determinen su rol definitivo en la posible reducción del asma y las sibilancias en pacientes pediátricos.
La flora microbiana intestinal, o microbioma, puede contribuir a la patogénesis de las enfermedades alérgicas debido a su efecto sustancial sobre la inmunidad de la mucosa. La exposición a una flora microbiana normal temprano en la vida permite un cambio en el equilibrio de linfocitos T helper 1 (Th1) / linfocitosT -helper 2 (Th2), favoreciendo la respuesta de células Th1. Las enfermedades atópicas, por el contrario, implican respuestas Th2 a alérgenos; las respuestas alérgicas anormales se cree que surgen en ausencia de un microbioma intestinal normal mientras que el sistema inmunológico está todavía en desarrollo, produciendo un cambio en el balance de citoquinas Th1/Th2 hacia una respuesta Th2, y una activación consecuente de citoquinas Th2 tales como la Interleuquina (IL)-4, IL-5 e IL-13, así como una mayor producción de inmunoglobulina (Ig) E.
Los probióticos, definidos como "microorganismos vivos, que, cuando se administran en cantidades adecuadas, confieren un beneficio de salud para el huésped" por la Organización Mundial de la Salud, potencialmente pueden modular la respuesta inmune, lo que resulta en la estimulación de citoquinas Th1 que pueden suprimir las respuestas Th2. Por lo tanto, varios estudios fueron diseñados para examinar la eficacia de los probióticos en muchos trastornos alérgicos. Sin embargo, los resultados en la atopía y el asma han sido contradictorios, y varios de estos informes pueden no haber tenido el poder suficiente. En el presente estudio, los autores realizaron un meta-análisis de estudios aleatorizados controlados para determinar si la administración de probióticos durante el embarazo y/o después del nacimiento disminuye la incidencia de atopía y asma en niños pequeños en comparación con el placebo.
Métodos
Se registra un protocolo del meta-análisis en PROSPERO (Registro Número: 42013004176) (http://www.crd.york.ac.uk/PROSPERO/display_record.asp?ID=CRD4201300416 ).
Fuentes de datos
Se realizaron búsquedas en Medline, Highwire, Web de Conocimiento, en el Índice Acumulativo de Literatura sobre Salud y Enfermería, y en el Registro Central Cochrane de Ensayos Controlados de estudios aleatorizados que evaluaran el efecto de la suplementación con probióticos en las enfermedades alérgicas en niños hasta marzo de 2013.
En todas las bases de datos se utilizaron las siguientes palabras claves: "probióticos" en asociación con "asma", "sibilancias", "rinitis", “atopía", "alergia", "inmunoglobulina", "IgE", "sensibilización", o "eczema". En Medline, los autores realizaron la búsqueda en base a los siguientes términos médicos: Probiótico Y (Asma o Sibilancias o Rinitis o Fiebre del Heno o Atopía o Alergia o Inmunoglobulina o IgE o Sensibilización o Eczema). La búsqueda se limitó a niños utilizando los límites "Humanos" y "Niño: nacimiento – 18 años". Además, los autores evaluaron manualmente las referencias de los artículos seleccionados para buscar estudios adicionales pertinentes.
Selección de los estudios
Todos los estudios recuperados de las diferentes bases de datos utilizando las estrategias de búsqueda antes mencionadas fueron derivados a un programa de gestión de referencia con base Web (Refworks [Pro-Quest, Ann Arbor, MI]), con eliminación de los duplicados. Los estudios sobre probióticos que cumplían con los siguientes criterios predefinidos se incluyeron en el meta-análisis.
Diseño del estudio
Se incluyeron estudios doble ciego, aleatorizados, controlados con placebo, publicados en inglés (o en otros idiomas aparte del inglés, cuando existía la posibilidad de traducirlos al inglés mediante el uso de servicios de traducción en línea). La randomización se consideró adecuada cuando un estudio se describió como aleatorizado, incluso si el método preciso de aleatorización no fuera informado. Los ensayos fueron incluidos si la intervención (suplementación con probióticos) estaba dirigida hacia el niño y/o la madre embarazada. Se consideraron los estudios cruzados sólo si el análisis era realizado por separado para la primera mitad del estudio, y los resultados estaban disponibles.
Población
Se incluyeron niños en los que se midieron resultados entre el nacimiento y los 18 años de edad, sin antecedentes de enfermedades atópicas al momento de la suplementación con probióticos. Los niños con enfermedades atópicas fueron considerados sólo para el resultado "IgE total".
Intervención
Se evaluaron los probióticos bacterianos (única cepa o mezclas) administrados antes del nacimiento y/o luego del mismo durante el primer año de vida para la prevención de las enfermedades atópicas. El uso de los probióticos después del primer año de vida sólo se consideró para el resultado "IgE total", al evaluar el efecto de los probióticos en la IgE total de niños atópicos y no atópicos.
Control
Los sujetos control fueron niños que recibieron un placebo.
Resultados
Los resultados incluyeron el nivel de IgE total, la sensibilización atópica y asma/sibilancias. Se midieron los niveles de IgE total mediante el uso de inmunoensayo. La sensibilización atópica se definió como un resultado positivo en una prueba cutánea (PC) y/o una IgE específica elevada (> 0.35 KU/L) frente a cualquier alimento o alérgeno inhalante. Cuando los datos fueron informados por separado como PC positiva o IgE elevada, se seleccionaron los datos de las PCs positivas. Se definió como asma/sibilancias al informe de los padres del diagnóstico médico o al diagnóstico directo por un profesional participante en el ensayo.
Dos autores evaluaron de forma independiente todas las referencias de acuerdo con los criterios de selección. La selección inicial después de la eliminación de duplicados se basó en la evaluación del título y el resumen, y la selección final fue realizada utilizando los textos completos. Los criterios de exclusión fueron: (1) diseño del estudio no elegible (por ejemplo, estudios controlados con placebo no aleatorizados, estudios observacionales, estudios cruzados sin un análisis por separado de la primera mitad); (2) población no elegible (por ejemplo, estudios en animales, estudios incluyendo adultos > 18 años); (3) intervención no elegible (por ejemplo, administración de productos distintos a los probióticos o asociación de probióticos con otros productos tales como prebióticos); (4) resultados no elegibles, que incluyeran otros resultados distintos a los de las enfermedades alérgicas.
En la selección final, basada en la evaluación del texto completo, los criterios para la exclusión fueron la intervención o los resultados no elegibles (estudio sobre enfermedades alérgicas que no incluyera datos sobre el asma, las sibilancias, la IgE total, o la sensibilización atópica después del seguimiento). Cuando fue posible, los autores que midieron los resultados de interés después del seguimiento pero que los no informaron fueron contactados para obtener información adicional. Las diferencias de opinión para la inclusión se resolvieron mediante acuerdo.
Extracción de los datos
Utilizando un formulario de extracción de datos uniforme, dos de los autores recuperaron de forma independiente y a partir de los artículos de texto completo los datos de referencia (primer autor, año de publicación), el momento de suplementación con probióticos (prenatal y/o después del parto), la cepa de probiótico administrada, la dosis y la duración de la suplementación, la edad de los participantes al inicio y al final del seguimiento, las definiciones de resultado, el número total de participantes, el número de participantes y de casos en los grupos de intervención y control, los niveles medios de IgE total y el desvío estándar (DE) o intervalo de confianza (IC) correspondiente. Cuando los estudios usaron la misma población, se conservó aquel con el seguimiento más largo en el tiempo para el análisis apropiado. Los desacuerdos en la extracción de datos entre los 2 autores se resolvieron mediante discusión mutua y, ante la necesidad, por consulta con un tercer autor.
El acuerdo entre los revisores en la selección de los estudios se determinó mediante el uso de la estadística k de Cohen (k).
Evaluación de la calidad
La calidad metodológica de los ensayos clínicos aleatorios individuales se evaluó utilizando la escala de Jadad. Esta se calcula utilizando 3 ítems que evalúan la asignación al azar, el cegamiento y las discontinuaciones, lo que resulta en una puntuación total entre 0 (calidad más baja) y 5 (mayor calidad). Puntajes de 3 a 5 fueron considerados como de alta calidad.
Análisis
Los datos recogidos se combinaron para generar estimaciones resumidas, y cada estudio se ponderó por el tamaño de efecto de su varianza inversa. Para evaluar el efecto de los probióticos, se calcularon los riesgos relativos (RRs) para el desarrollo de asma y sensibilización atópica y se ponderaron las diferencias medias (DMP) para la IgE total entre los grupos intervención y control, utilizando los métodos de efectos aleatorios de DerSimonian y Lair. El análisis de efectos aleatorios no sólo pondera cada estudio por su varianza inversa sino que también incluye las variaciones dentro de- y entre estudios; es más conservador que los modelos de efectos fijos, proporcionando IC mayores cuando existe heterogeneidad entre estudios. Se evaluó la heterogeneidad en los resultados entre los estudios utilizando estadística Q de Cochran. Dada la baja potencia de la prueba, el nivel de significación fue definido como P < 0.10. El I2 se utilizó para cuantificar el alcance de la verdadera heterogeneidad. Se realizó una evaluación del sesgo de publicación con la prueba de Egger, en base a un gráfico en embudo y a la regresión de la estimación del efecto estandarizado como una medida de precisión.
Se llevaron a cabo análisis de subgrupos según el tiempo de administración de los probióticos, el grupo de edad, la definición de resultado (PC o IgE específica elevada para la sensibilización atópica, asma o sibilancias para asma/sibilancias), y análisis de meta regresión para explorar las posibles fuentes de heterogeneidad y evaluar los efectos de diferentes factores tales como la cepa probiótica (s), la edad basal de los participantes, la dosis administrada, la duración de la suplementación, y la duración del seguimiento de la eficacia de los probióticos, así como la suplementación materna con probióticos durante la lactancia frente a la suplementación directa del lactante. Todos los análisis se realizaron con Stata versión 11 (StataCorp, College Station, TX) y un valor de P de 0,05 se consideró estadísticamente significativo.
Resultados
Se identificaron un total de 1081 artículos: 355 artículos de PubMed, 44 del Índice Acumulativo, 518 de la Web de Conocimiento, 73 de Highwire y 91 del Registro Central de Cochrane. De éstos, 25 estudios fueron incluidos en el meta-análisis para 20 cohortes con un total de 4.031 participantes. Hubo acuerdo completo en 697 de los 778 artículos (después de la exclusión de duplicados) luego de la selección del título y el resumen (acuerdo entre autores: k = 79,2%) y en 62 de 68 artículos después de la revisión del texto completo (acuerdo entre autores: k = 81,8%).
Características de los estudios incluidos
Los estudios incluidos fueron publicados entre 2001 y 2012. Los ensayos fueron realizados principalmente en Europa, pero también en Asia, Australia, y Nueva Zelanda. Los probióticos se administraron prenatalmente (en mujeres embarazadas) en 2 ensayos, prenatalmente a mujeres embarazadas y en el periodo postnatal directamente a los niños en 10 ensayos, y sólo después del nacimiento a los niños en 9 estudios. Diez ensayos utilizaron Lactobacillus, y 8 utilizaron mezclas de probióticos. Wickens y col., Rautava y col., y Gore y col. utilizaron brazos separados de Lactobacillus y Bifidobacterium en comparación con un grupo placebo. Todos menos 2 estudios tenían una puntuación de Jadad de 3 a 5 y fueron considerados de buena calidad metodológica.
La sensibilización atópica se definió por una PC positiva y/o un nivel de IgE > 0.35 KU/L ante cualquier alimento o alérgeno inhalante (por ejemplo gatos, perros, ácaros, clara de huevo, leche de vaca, maní, polen de abedul, hierba o pasto) en la mayoría de los estudios que evaluaron sensibilización atópica. Uno evaluó solamente alérgenos alimentarios y otro sólo alérgenos inhalantes. El diagnóstico de asma/sibilancias sólo fue reportado por los padres mediante un cuestionario, y en 5 estudios, verificado por un médico, enfermera o por un registro de medicación para el asma.
Algunos estudios utilizaron las mismas poblaciones: Kalliomäki y col. incluyeron una cohorte de 159 madres reclutadas en Finlandia en 3 estudios; 3 estudios analizaron una cohorte de 231 mujeres embarazadas atópicas de Australia, y Wickens y col. se centraron en 223 mujeres embarazadas de Kiwi que bien ellas o los padres de sus bebés eran atópicos en 2 estudios. Sin embargo, estas cohortes fueron incluidas sólo una vez en los diferentes análisis (el informe más reciente de cada caso).
IgE sérica total
Nueve estudios representando cohortes de 9 ensayos fueron incluidos (1.103 niños). En general, los probióticos fueron efectivos en la reducción de la IgE total (DMP:-7,59 U/ml [IC 95%: -14,96 a -0,22], P =0,044), sin heterogeneidad significativa entre los estudios (I2 nula, prueba Q de Cochran, P = 0,573). En los análisis de subgrupos, el efecto de los probióticos en la IgE total fue significativo entre los niños con atopía (DMP: -35,12 U/ml [IC 95%: -69,82 a -0,42], P = 0,047) pero no en los niños no atópicos con antecedentes familiares. Por edad, el efecto de los probióticos fue significativo en niños ≥ 2 años de edad (DMP: -12,74 U/ml [IC 95%: -24,55 a -0,93]; P = 0,035).
Los análisis de meta-regresión multivariados, que incluyeron la edad de referencia, la edad al seguimiento, el sexo, la duración del tratamiento, la dosis diaria y total, y la duración del seguimiento, mostraron que la duración del seguimiento modificó el efecto de los probióticos en la IgE total: la reducción en la IgE fue más pronunciada con el seguimiento más prolongado (coeficiente de correlación [β]: -1,95 [IC 95%: -3,69 a -0,21], P = 0,028). El gráfico en embudo y la prueba de Egger no mostraron evidencia de sesgo de publicación (P = 0,23).
Sensibilización atópica
Se incluyeron veintiún estudios que caracterizaron 14 ensayos (N = 2.797). En general, los probióticos tuvieron un efecto parcialmente significativo en la reducción del riesgo de sensibilización atópica, definida como un resultado positivo en la PC y/o una IgE específica elevada (RR: 0,90 [IC 95%: 0,80 a 1,00], P = 0,060). La reducción fue significativa cuando los probióticos se administraron prenatalmente y después del nacimiento (RR: 0,88 [IC 95%: 0,78-0,99], P = 0,035), pero no cuando se dieron sólo después del nacimiento (P = 0,825).
El análisis de subgrupos por definición de sensibilización atópica mostró un efecto protector significativo de los probióticos contra un resultado positivo en la PC a alérgenos comunes cuando se administraron prenatalmente y después del nacimiento (RR: 0,86 [IC 95%: 0,75 a 0,98], P = 0,027).
El efecto protector global contra la sensibilización atópica fue cercano a la significación (RR: 0,88 [IC 95%: 0,78 a 1,00], P =0,059) cuando se definió como un resultado positivo en la PC pero no fue significativo cuando se definió como un nivel elevado de IgE específica.
La meta-regresión multivariada mostró que la administración de Lactobacillus acidophilus se asoció con un aumento del riesgo de sensibilización atópica (β: 0,45 [IC 95%: 0,16 a 0,74], P = 0,002). El gráfico en embudo y la prueba de Egger no mostraron evidencia de sesgo de publicación (P = 0,57).
Asma/sibilancias
Se incluyeron catorce estudios a partir de 10 ensayos (n = 3143). Los probióticos no redujeron significativamente la presencia de asma/sibilancias (RR: 0,96 [IC 95%: 0,85 a 1,07]). No se encontró asociación significativa en los análisis de subgrupos por grupos de edad, duración del tratamiento, duración del seguimiento, cepa de probiótico, dosis administrada, o definición de resultado (sibilancias alguna vez, asma/sibilancias recurrentes, asma/sibilancias por atopía). El gráfico en embudo y la prueba de Egger no mostraron evidencia de sesgo de publicación (P = 0,25).
Discusión
Los resultados de este meta-análisis indican que la administración de probióticos temprano en la vida es eficaz en la reducción de los niveles de IgE y del riesgo de sensibilización atópica en niños pequeños, pero no del riesgo de asma o sibilancias. No hubo ninguna diferencia basada en la duración de la administración (prenatalmente a las madres y luego en el periodo post-natal en comparación con sólo después del nacimiento) con respecto a la IgE, pero la disminución en el riesgo de atopía fue significativa sólo cuando la administración de probióticos se inició durante el embarazo y continuó después del nacimiento. Los resultados del análisis de meta-regresión mostraron que el efecto de los probióticos en la disminución del nivel de IgE total fue más pronunciado en los períodos de seguimiento más largos, y que su efecto en la disminución del riesgo de sensibilización atópica puede depender de las cepas específicas administradas.
Estos resultados son consistentes con la hipótesis de la higiene, que propone que la falta relativa de exposición microbiana durante la lactancia y la primera infancia puede dar lugar a un desequilibrio entre las respuestas inmunes de tipo Th1 y Th2 y puede inducir el desarrollo de respuestas alérgicas mediadas por IgE. Se ha postulado que la exposición temprana a bacterias comensales juega un papel crucial en la polarización Th1/Th2 y en la maduración de mecanismos regulatorios inmunes adecuados. El intestino es la fuente más importante de estimulación microbiana postnatal del sistema inmune, y los niños atópicos pueden tener diferente microbioma intestinal en comparación con sus pares no atópicos; se han encontrado tales diferencias entre los casos de eczema y los controles sanos, así como entre países con alta y baja incidencia de enfermedades atópicas. La administración de probióticos a temprana edad puede promover un microbioma intestinal saludable, que a su vez modula la maduración de la respuesta inmune.
Los trastornos alérgicos se asocian con un desplazamiento del equilibrio de citoquinas Th1/Th2 hacia una respuesta Th2. Esta acción conduce a la activación de citoquinas Th2 tales como IL-4, IL-5 e IL-13, así como a una mayor producción de IgE. Los probióticos pueden modular los receptores tipo toll y las proteínas de reconocimiento de proteoglicanos de los enterocitos, lo que lleva a la activación de las células dendríticas y a una respuesta Th1; la estimulación resultante de las citoquinas Th1 puede suprimir las respuestas Th2. Los estudios pediátricos sugieren que el uso de probióticos en niños con trastornos atópicos, tales como alergias a los alimentos o dermatitis atópica, resulta en la mejora de la producción de interferón-ˠ (una citoquina Th1), en la disminución de la IgE, y la disminución de la secreción de factor de necrosis tumoral-α inducida por antígeno, IL-5 e IL-10. En modelos animales de alergia inducida por ovoalbúmina (OVA), los probióticos (L acidophilus AD031 y Bifidobacterium lactis AD011) disminuyeron significativamente los niveles séricos de IgE OVA-específica, IgA, e IgG1; regulando hacia arriba al interferón-ˠ y la IL-10, y hacia abajo a la IL- 4.
Los probióticos también pueden prevenir la atopía vía inflamación sistémica o local de bajo grado: se han hallado concentraciones aumentadas de proteína C reactiva en niños con eczema y alergia a leche de vaca que fueron tratados con probióticos. Los mayores niveles de proteína C reactiva en niños con riesgo de alergia a los 6 meses de edad se asociaron con menor riesgo de eczema y enfermedad alérgica a los 2 años de edad después del tratamiento con probióticos en combinación con prebióticos. Los probióticos pueden inducir marcadores inflamatorios fecales, tales como α1-antitripsina, factor de necrosis tumoral α, y calprotectina, que han sido asociados con altos niveles de IgA fecal y un menor riesgo de enfermedad alérgica asociada a IgE, lo que sugiere que una inflamación intestinal mínima puede desempeñar un papel en su mecanismo de acción.
Aunque los análisis agrupados hallaron un efecto significativo de los probióticos sobre la IgE total y el riesgo de sensibilización atópica, no se encontró una significativa reducción del riesgo similar para el asma y las sibilancias, lo cual es consistente con estudios previos en adultos. Estudios en animales con probióticos han mostrado una disminución de la respuesta inflamatoria ante un desafío único a un alérgeno, pero no repetido: en modelos murinos de asma sensibilizados con OVA, la administración de Lactobacillus reuteri ATCC 23272, Lactobacillus rhamnosus GG o B. lactis Bb-12 disminuyó significativamente la hiperreactividad de las vías respiratorias y redujo la cantidad de células inflamatorias en el líquido de lavado broncoalveolar después del desafío con OVA intranasal. L. rhamnosus GG y B. lactis también aumentan las células T reguladoras naturales en los pulmones de ratones asmáticos. Sin embargo, MacSharry y col. informaron que la inhibición de ciertos componentes de la inflamación de la vía aérea inducida por alérgenos por la administración de Bifidobacterium longum fue superada después de la exposición repetida al alérgeno.
En base a los resultados del análisis de meta-regresión para la IgE y la sensibilización atópica, se especula que la falta de efecto de los probióticos en la reducción del riesgo de asma/sibilancias puede haber sido debido a las combinaciones específicas de cepas utilizadas en estos ensayos o debido a una longitud insuficiente de seguimiento; estas teorías tendrán que ser probadas prospectivamente. Los estudios en animales sugieren que los efectos de los probióticos sobre las respuestas de la vía aérea inducidas por alérgenos pueden ser sensibles al organismo utilizado: se ha demostrado que L. reuteri, pero no Lactobacillus salivarius, inhibe las respuestas alérgicas de las vías respiratorias en ratones sensibilizados, y un estudio reciente realizado por Hougee y col. demostró que Bacillus brevis tiene efectos inmunomoduladores dependientes de la cepa. La duración y el momento de la alimentación también son factores determinantes de la eficacia antiinflamatoria; Forsythe y col. hallaron que se requiere un periodo de alimentación de por lo menos 9 días para lograr una inhibición importante de la eosinofilia y de la hiperreactividad de las vías respiratorias en ratones. Para ser más eficaces, las especies bacterianas utilizadas como probióticos deben ser resistentes al ácido y a la bilis para sobrevivir y hacer el tránsito a través del tracto gastrointestinal superior, e incluso las cepas más resistentes pueden cultivarse en las heces por sólo 1 a 2 semanas después de la ingestión; por lo tanto, el consumo regular es vital.
Existen varias limitaciones potenciales en este estudio. Sólo se incluyeron artículos publicados en inglés o con resúmenes en inglés con información suficiente, lo que puede no ser representativo de todos los estudios realizados sobre el tema. Otra importante limitación en cualquier meta-análisis es la variabilidad entre estudios; aunque se utilizaron modelos de efectos aleatorios para tratar de tener en cuenta esta variabilidad y se realizaron análisis de meta-regresión para detectar efectos modificadores importantes, sólo se pueden analizar covariables que están disponibles a partir del manuscrito original. Por último, no se puede excluir completamente el riesgo de sesgo de publicación, aunque los gráficos en embudo y los análisis de la prueba de Egger no mostraron evidencia de tal sesgo para ninguno de los resultados.
Conclusiones
Los autores hallaron que la administración de probióticos en la vida temprana puede reducir la IgE total y proteger contra la sensibilización atópica pero no parece proteger contra el asma y las sibilancias. Por lo tanto, los probióticos seleccionados cuidadosamente y administrados durante el embarazo y la primera infancia pueden tener un papel en la prevención primaria de enfermedades atópicas, particularmente en lactantes de alto riesgo. Los ensayos futuros deberían considerar cepas específicas de probióticos, períodos de seguimiento más largos, y tal vez la asociación con oligosacáridos, particularmente cuando se evalúan los efectos de los probióticos en la reducción del riesgo de asma y sibilancias en el futuro.
Comentario
La prevalencia de las enfermedades alérgicas es significativa a nivel mundial, con diversas manifestaciones a nivel clínico. En este meta-análisis se destaca la importancia de los probióticos administrados prenatal como postnatalmente en la reducción de los niveles de IgE y de la sensibilización atópica. Se espera que los futuros estudios se explayen sobre los beneficios de la utilización de probióticos y determinen su rol definitivo en la posible reducción del asma y las sibilancias en pacientes pediátricos.
Suscribirse a:
Comentarios (Atom)